高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
以$\rm NaOH$、$\rm CuSO_{4}$和$\rm HCHO$为主要成分的镀液可在某些材料上镀铜,原理如下:$\rm Cu^{2+}+2HCHO+4OH^{-}→Cu+2HCOO^{-}+2H_{2}O+H_{2}↑$
基态$\rm Cu$原子的价层电子排布式为 。
$\\rm 3d^{10}4s^{1}$
"]]$\rm Cu$为$\rm 29$号元素,则基态$\rm Cu$原子的价层电子排布式为$\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$;
根据反应原理分析:
①镀铜反应中,利用了$\rm HCHO$的 性;每镀$\rm 1$ $\rm mol$铜,上述反应中转移电子 $\rm \;\rm mol$。
②选择$\rm HCHO$进行化学镀铜的原因之一是它易溶于水。下列分析正确的是 。
$\rm a.HCHO$、$\rm H_{2}O$均属于极性分子
$\rm b.HCHO$与$\rm H_{2}O$之间能形成氢键
$\rm c.$在醛基的碳氧双键中,电子偏向氧原子
还原 $\\rm ;$ $\\rm 4$ $\\rm ;$ $\\rm ab$
"]]①根据反应$\rm Cu^{2+}+2HCHO+4OH^{-}→Cu+2HCOO^{-}+2H_{2}O+H_{2}↑$可知,$\rm HCHO$中碳元素化合价为$\rm 0$价转化为$\rm HCOO^{-}$中碳元素化合价为$\rm +2$价,则说明镀铜反应中,利用了$\rm HCHO$的还原性,根据反应中元素化合价可知,反应中还原剂只有$\rm HCHO$,根据离子方程式可知,每消耗$\rm 2$ $\rm mol$ $\rm HCHO$,生成$\rm 1$ $\rm mol$ $\rm Cu$,转移$\rm 4$ $\rm mol$电子;
②$\rm HCHO$、$\rm H_{2}O$均属于极性分子,$\rm HCHO$与$\rm H_{2}O$之间能形成氢键,根据相似相溶原理可知,$\rm HCHO$易溶于水,与醛基的碳氧双键中,电子偏向氧原子无关;
镀液中的$\text{SO}_{\text{4}}^{\text{2-}}$、$\rm HCHO$、$\rm H_{2}O$三种微粒,空间结构为三角形的是 。
$\\rm HCHO$
"]]$\text{SO}_{\text{4}}^{\text{2-}}$的价层电子对数为$4+\dfrac{6+2-4\times 2}{2}=4$,孤电子对数为$\rm 0$,其空间结构为正四面体形,$\rm HCHO$中$\rm C$是中心原子,根据$\rm Vesper$理论,$\rm C$提供$\rm 4$个价电子,$\rm H$提供$\rm 1$个价电子,$\rm O$不提供价电子,总共$\rm 6$个价电子,其空间结构为平面三角形,$\rm H_{2}O$的价层电子对数为$2+\dfrac{6-2\times 1}{2}=4$,孤电子对数为$\rm 2$,其空间结构为$\rm V$形,则镀液中的$\text{SO}_{\text{4}}^{\text{2-}}$、$\rm HCHO$、$\rm H_{2}O$三种微粒,空间结构为三角形的是$\rm HCHO$;
为防止$\rm Cu^{2+}$与$\rm OH^{-}$形成沉淀,可加入$\rm EDTA$使$\rm Cu^{2+}$形成配合物。$\rm EDTA$能电离出$\rm H^{+}$和$\rm EDTA^{4-}$:
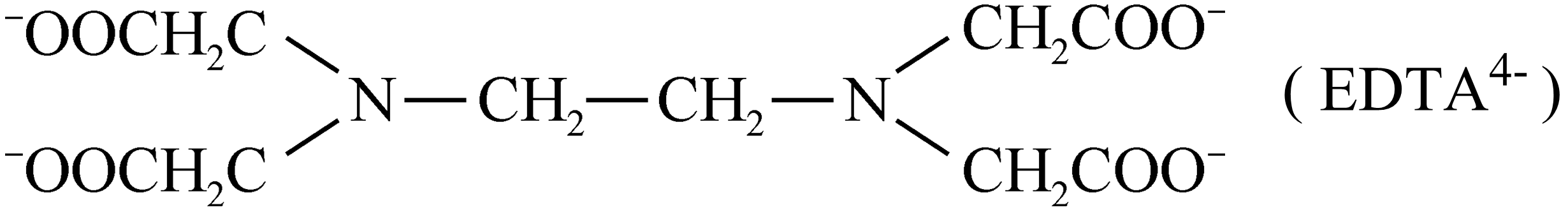
$\rm EDTA^{4-}$中除部分$\rm O$外,还能与$\rm Cu^{2+}$配位的原子是 。
$\\rm N$
"]]$\rm EDTA^{4-}$中的$\rm N$原子含有一对孤电子对,$\rm Cu^{2+}$含有空轨道,两者之间可以形成配位键,故$\rm EDTA^{4-}$中除部分$\rm O$外,还能与$\rm Cu^{2+}$配位的原子是$\rm N$;
铜$\rm —$镍镀层能增强材料的耐蚀性。按照核外电子排布,把元素周期表划分为$\rm 5$个区。$\rm Ni$位于 区。
$\\rm d$
"]]根据元素周期表的分区依据可知,$\rm Ni$位于$\rm d$区;
聚酰亚胺具有高强度、耐紫外线、优良的热氧化稳定性等性质。某聚酰亚胺具有如下结构特征:
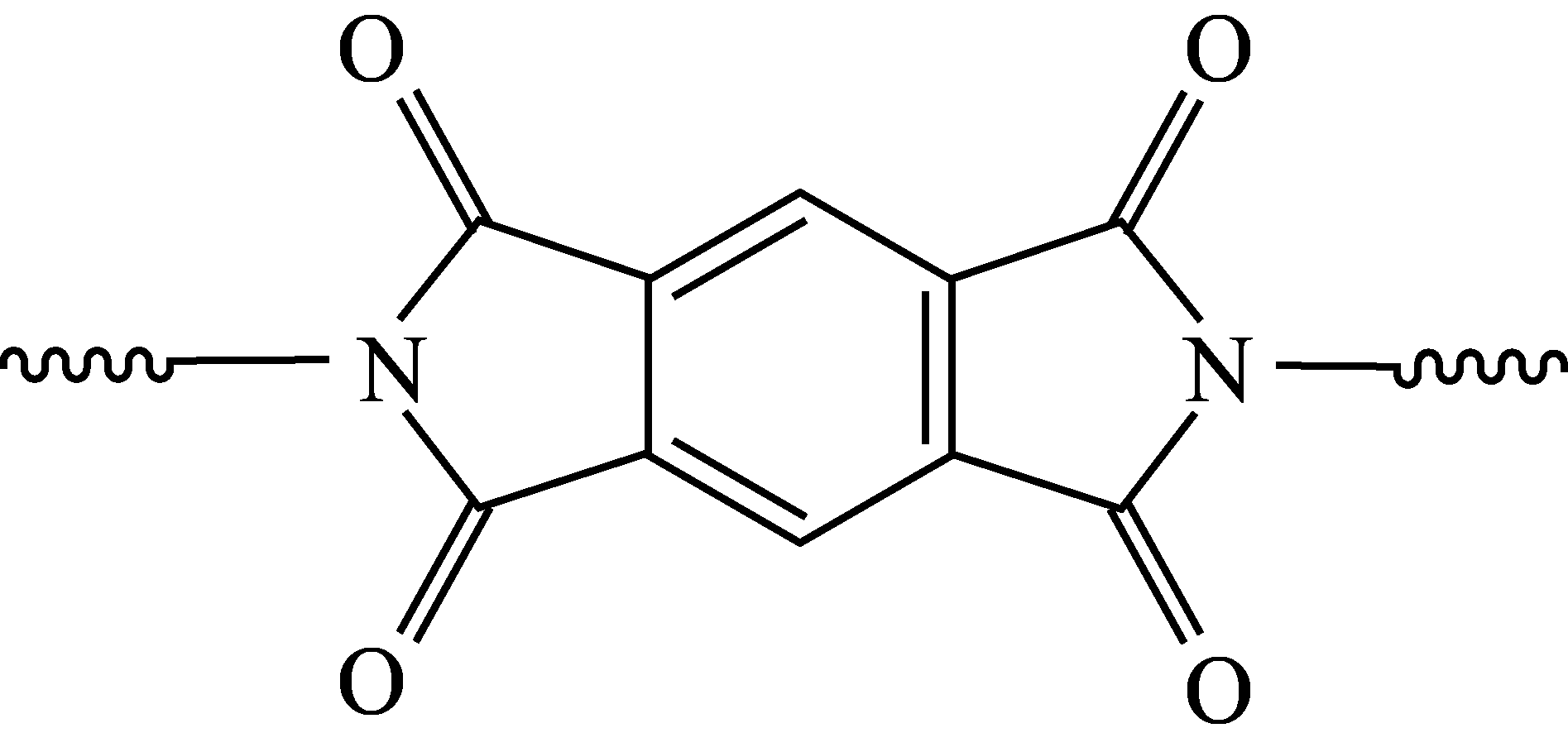
上述方法不适合在该聚酰亚胺基材上直接镀铜。原因是:
① 。
②聚合物有可能与$\rm Cu^{2+}$配位。
聚酰亚胺在碱性条件下会发生水解
"]]上述方法不适合在该聚酰亚胺基材上直接镀铜,原因是:该聚酰亚胺基材上存在酰胺键,在碱性条件下易发生水解而遭到破坏。
高中 | 配合物理论题目答案及解析(完整版)
