高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
某钠离子电池以$\rm NaCl{{O}_{4}}$的碳酸丙烯酯溶液作电解质溶液,${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$作正极材料,$\rm Na$作负极材料。
$\rm C{{O}_{2}}$与环氧丙烷$\rm ($![]() $\rm )$在一定条件下反应制得碳酸丙烯酯。
$\rm )$在一定条件下反应制得碳酸丙烯酯。
①$\rm C{{O}_{2}}$是 $\rm ($填“极性”或“非极性”$\rm )$分子。
②环氧丙烷中,$\rm O$原子的杂化轨道类型是 杂化。
③环氧丙烷的沸点 $\rm C{{O}_{2}}($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,解释其原因: 。
非极性;$\\rm sp^{3}$;$\\rm \\gt $;二者均为分子构成的物质,环氧丙烷的相对分子质量更大,分子的极性更大,范德华力更大
"]]①$\rm CO_{2}$分子中$\rm C$原子与$\rm 2$个$\rm O$原子形成$\rm 4$个共价键,由于是$\rm C$、$\rm O$是不同元素的原子之间形成的共价键,因此$\rm C=O$是极性键,但由于在$\rm CO_{2}$分子中这$\rm 3$个原子在同一条直线上,空间排列对称,正负电荷重心重合,因此$\rm CO_{2}$分子属于非极性分子。
②在环氧丙烷中,$\rm O$原子的孤电子对数为$\rm 2$,成键原子数为$\rm 2$,所以其价层电子对数为$\rm 2+2=4$,故$\rm O$的杂化类型是$\rm sp^{3}$杂化。
③$\rm CO_{2}$、环氧丙烷都是由分子通过分子间作用力结合形成的分子晶体。物质的相对分子质量越大,分子的极性越强,分子间作用力就越强,克服分子间作用力使物质熔化、气化消耗的能量就越多,物质的熔沸点就越高。由于环氧丙烷的相对分子质量更大,分子的极性更大,范德华力更大,故物质的沸点:环氧丙烷$\rm \gt CO_{2}$。
$\rm MnC{{l}_{2}}$溶液与$\rm N{{a}_{4}}\left[ Fe{{(CN)}_{6}} \right]$溶液混合可制备${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$晶体。
①基态$\rm Mn$原子的电子排布式是 。
②$\rm C{{N}^{-}}$的性质与卤素离子相近,被称为拟卤离子,$\rm {{(CN)}_{2}}$被称为拟卤素。
$\rm i$.$\rm {{(CN)}_{2}}$与$\rm {{H}_{2}}O$反应的生成物的结构式分别是$\rm {H}-{C} \equiv {N}$、 。
$\rm ii$.$\rm HCN$有酸性但乙炔无明显酸性,$\rm HCN$的酸性比乙炔的强的原因是 。
③为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将$\rm MnC{{l}_{2}}$溶液与柠檬酸钠$\rm (N{{a}_{3}}{{C}_{6}}{{H}_{5}}{{O}_{7}})$溶液混合,发生反应:$\rm 3M{{n}^{2+}}+2{{C}_{6}}{{H}_{5}}{O}_{7}^{3-}\rightleftharpoons M{{n}_{3}}{{({{C}_{6}}{{H}_{5}}{{O}_{7}})}_{2}}$,再加入$\rm N{{a}_{4}}\left[ Fe{{(CN)}_{6}} \right]$溶液以制备${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$晶体。阐述制备晶体过程中柠檬酸钠溶液的作用: 。
$\\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{2}$;$\\rm H-O-C≡N$;$\\rm N$原子的电负性大,$\\rm -CN$具有吸电子效应,使$\\rm HCN$中$\\rm H-C$的极性更大,更易断裂;柠檬酸钠与$\\rm Mn^{2+}$反应生成$\\rm Mn_{3}(C_{6}H_{5}O_{7})_{2}$,降低了$\\rm Mn^{2+}$的浓度,使制备晶体的反应速率减小;随着反应进行,$\\rm Mn^{2+}$的浓度降低,$\\rm 3M{{n}^{2+}}+2{{C}_{6}}{{H}_{5}}O_{7}^{3-}\\rightleftharpoons M{{n}_{3}}{{({{C}_{6}}{{H}_{5}}{{O}_{7}})}_{2}}$逆向进行,释放出$\\rm Mn^{2+}$,使制备晶体的反应缓慢且平稳
"]]①$\rm Mn$是$\rm 25$号元素,根据构造原理,可知基态$\rm Mn$原子的电子排布式是$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{2}$。
②ⅰ$\rm .(CN)_{2}$被称为拟卤素,根据$\rm Cl_{2}+H_{2}O\rightleftharpoons HCl+HClO$的性质,可知$\rm (CN)_{2}$与$\rm H_{2}O$反应产生$\rm HCN$、$\rm HOCN$,反应方程式为:$\rm (CN)_{2}+H_{2}O\rightleftharpoons HCN+HOCN$,根据原子的价电子数目,可知二者的结构式分别是$\rm H-C≡N$、$\rm H-O-C≡N$。
ⅱ$\rm .HCN$有酸性但乙炔无明显酸性,$\rm HCN$的酸性比乙炔的强的原因是:$\rm N$原子的电负性大,$\rm -CN$具有吸电子效应,使$\rm HCN$中$\rm H-C$的极性更大,更易断裂,因而更容易电离产生$\rm H^{+}$。
③根据反应方程式可知:在制备晶体过程中柠檬酸钠溶液的作用是柠檬酸钠与$\rm Mn^{2+}$反应生成$\rm Mn_{3}(C_{6}H_{5}O_{7})_{2}$,从而降低了溶液中$\rm Mn^{2+}$的浓度,使制备晶体的反应速率减小。反应速率越慢,产生的晶体的晶粒就越大,越完整,缺陷就越少。随着反应进行,$\rm Mn^{2+}$的浓度降低,可逆反应$\rm 3M{{n}^{2+}}+2{{C}_{6}}{{H}_{5}}O_{7}^{3-}\rightleftharpoons M{{n}_{3}}{{({{C}_{6}}{{H}_{5}}{{O}_{7}})}_{2}}$的化学平衡逆向进行,释放出$\rm Mn^{2+}$,使制备晶体的反应缓慢且平稳。
钠离子电池的正极材料${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$在充、放电过程中某时刻的晶胞示意图如下。
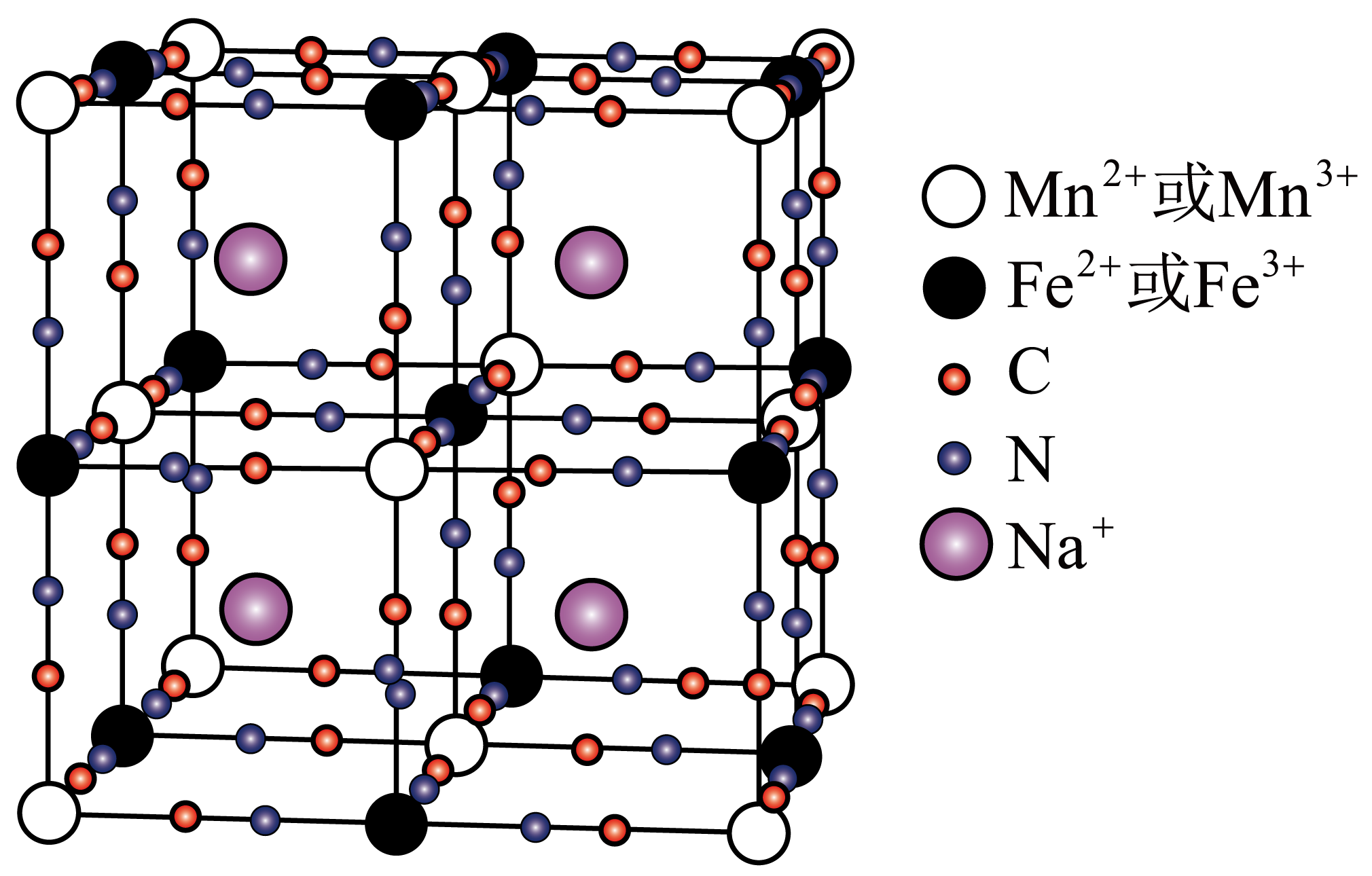
①${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$中存在的化学键有配位键、 。
②此时刻晶胞边长为$a\ \rm nm$,已知${\rm N}{{\rm a}_{x}}\rm \left[ MnFe{{(CN)}_{6}} \right]$的摩尔质量是$M\ \rm g\cdot mo{{l}^{-1}}$,密度为$d\ \rm g\cdot c{{m}^{-3}}$,阿伏加德罗常数${{N}_{\rm A}}$为 $\rm ($用代数式表示,$\rm 1 {\ nm}=10^{-7}\ {cm})$。
离子键、$\\rm ($极性$\\rm )$共价键;$\\dfrac{4M}{{{a}^{3}}d}\\times {{10}^{21}}\\ \\rm mol^{-1}$
"]]①${\rm Na}_{x}\rm [MnFe(CN)_{6}]$晶体是离子晶体,外界$\rm Na^{+}$与内界离子$\rm [MnFe(CN)_{6}]^{x-}$之间以离子键结合,在内界离子中,中心原子与配位体之间以配位键结合;在配位体$\rm CN^{-}$中$\rm C$、$\rm N$原子之间以极性共价键结合,故${\rm Na}_{x}\rm [MnFe(CN)_{6}]$晶体中含有的化学键类型有离子键、配位键、极性共价键。
②由晶胞结构可知:$\rm 4$个$\rm Na^{+}$位于体内,$\rm Mn$位于顶点和面心,$\rm Mn$原子的个数为:$\rm 8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,$\rm Na$:$\rm Mn=4:4=1:1$,$x=1$,晶胞质量为$\dfrac{M\times 4}{{{N}_{\rm A}}}\ \rm g$,晶胞体积$={{(a\times {{10}^{-7}})}^{3}}\ \rm c{{m}^{3}}$,$d=\dfrac{m}{V}=\dfrac{\dfrac{M\times 4}{{{N}_{\rm A}}}}{{{a}^{3}}\times {{10}^{-21}}}\Rightarrow {{N}_{\rm A}}=\dfrac{4M}{{{a}^{3}}d}\times {{10}^{21}}\ \rm mol^{-1}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
