高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
如图所示的铼配合物离子能电催化还原$\text{W}{{\text{Y}}_{2}}$。短周期元素$\text{W}\text{X}\text{Y}\text{Z}$的原子序数依次增大。标准状况下,$\rm WY$和${{\text{X}}_{2}}$是等密度的无色气体,${{\text{Z}}_{2}}$是黄绿色气体。下列说法错误的是$(\quad\ \ \ \ )$
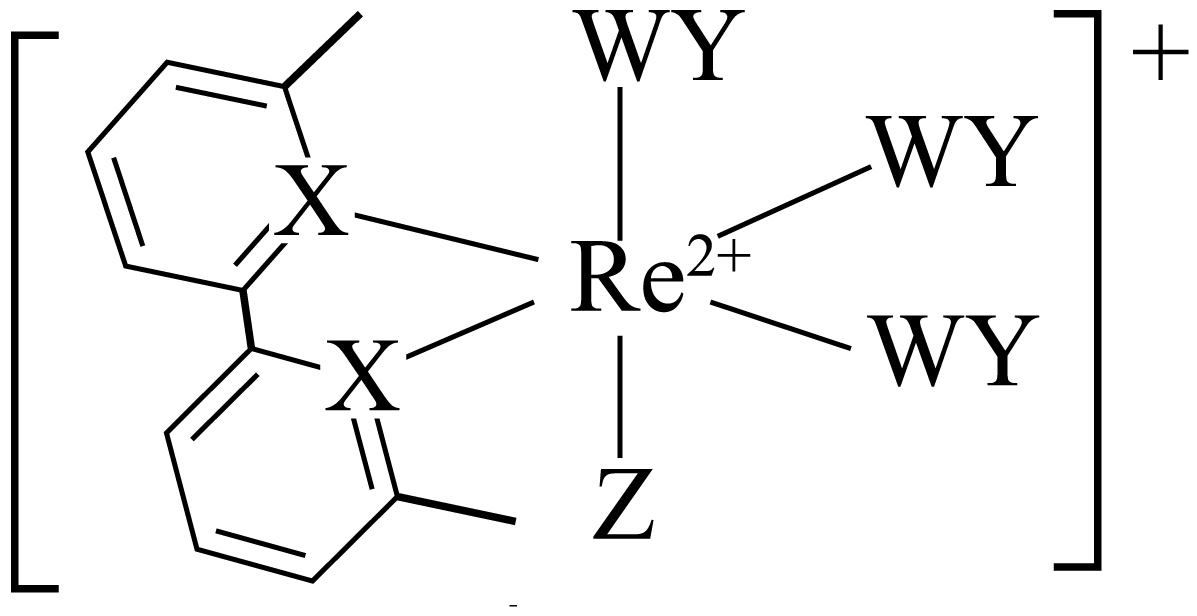
第一电离能:$\\text{X}\\gt \\text{Y}$
","图中$\\rm X$原子的杂化方式为$\\mathrm{sp}^2$
","$\\text{Z}$元素以原子的形态与$\\text{R}{{\\text{e}}^{2+}}$配位
","$\\rm Y$的电负性大于$\\text{W},\\text{WY}$中的化学键是极性键
"]分析:短周期元素$\text{W}\text{X}\text{Y}\text{Z}$的原子序数依次增大。${{\text{Z}}_{2}}$是黄绿色气体,$\rm Z$为氯;$\rm X$形成$\rm 3$个共用电子对,$\rm X$与$\rm Re^{2+}$之间为配位键,推测$\rm X$为氮,标准状况下,$\rm WY$和${{\text{X}}_{2}}$是等密度的无色气体,则$\rm WY$为一氧化碳、${{\text{X}}_{2}}$为氮气,故$\rm W$为碳、$\rm X$为氮、$\rm Y$为氧、$\rm Z$为氯;
$\rm A$.同一周期随着原子序数变大,第一电离能变大,$\rm N$的$\rm 2p$轨道为半充满稳定状态,第一电离能大于同周期相邻元素,故第一电离能大小:$\rm N\gt O$,$\rm A$正确;
$\rm B$.图中$\rm X$原子处于环中,且存在平面大$\rm \pi$键,则其杂化方式为$\mathrm{sp}^2$,$\rm B$正确;
$\rm C$.由图可知,整个离子带$\rm 1$个单位正电荷,而其中$\text{R}{{\text{e}}^{2+}}$带$\rm 2$个单位正电荷,则氯元素以$\rm Cl^{-}$的形态与$\text{R}{{\text{e}}^{2+}}$配位,$\rm C$错误;
$\rm D$.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;$\rm O$的电负性大于$\rm C$,则$\rm CO$中的化学键是极性键,$\rm D$正确;
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
