高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ$\rm .$以$\text{C}{{\text{O}}_{\text{2}}}$和$\text{N}{{\text{H}}_{\text{3}}}$为原料合成尿素
$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-87\text{ kJ}/\text{mol}$。
该反应的化学平衡常数表达式为 。
$\\dfrac{c\\left( {{\\text{H}}_{2}}\\text{O} \\right)}{{{c}^{2}}\\left( \\text{N}{{\\text{H}}_{3}} \\right)\\cdot c\\left( \\text{C}{{\\text{O}}_{2}} \\right)}$
"]]可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值为化学平衡常数,$2 \mathrm{NH}_{3}(\mathrm{g})+\mathrm{CO}_{2}(\mathrm{g}) \rightleftharpoons \mathrm{CO}\left(\mathrm{NH}_{2}\right)_{2}(\mathrm{s})+\mathrm{H}_{2} \mathrm{O}(\mathrm{g})$反应,固体不计入平衡常数表达式,平衡常数表达式为$K=\dfrac{c\left( {{\text{H}}_{2}}\text{O} \right)}{{{c}^{2}}\left( \text{N}{{\text{H}}_{3}} \right)\cdot c\left( \text{C}{{\text{O}}_{2}} \right)}$;
研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
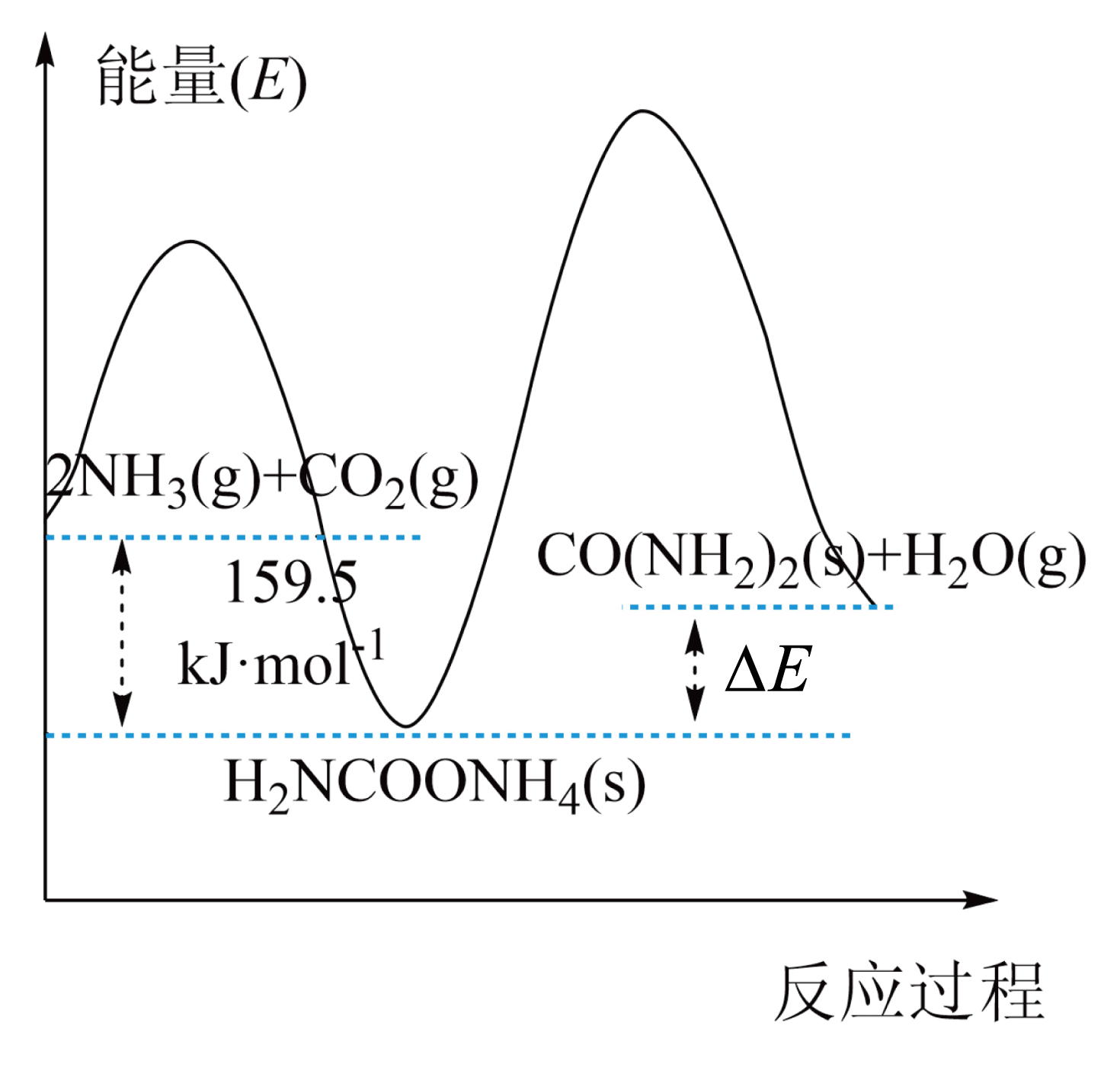
第一步:$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})\quad \Delta {{H}_{1}}$
第二步:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{2}}$
①图中$\Delta E=$ $\text{kJ}/\text{mol}$。
②反应速率较快的是 反应$\rm ($填“第一步”或“第二步$\rm )$。
$\\rm 72.5$ ; 第一步
"]]①$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-87\text{ kJ}/\text{mol}$
根据图示,②
根据盖斯定律①$\rm -$②得$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{2}}=+72.5\text{ kJ}/\text{mol}$
①可知图中$\Delta E=72.5\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
②第一步反应活化能小于第二步,活化能越小反应速率越快,反应速率较快的是第一步反应。
Ⅱ$\rm .$以$\text{C}{{\text{O}}_{\text{2}}}$和$\text{C}{{\text{H}}_{\text{4}}}$催化重整制备合成气:
$\text{C}{{\text{O}}_{2}}(\text{g})+\text{C}{{\text{H}}_{4}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\quad \Delta H=+247\text{ kJ}/\text{mol}$
在$\text{2 L}$的密闭容器中通入物质的量均为$\text{0}\text{.2 mol}$的$\text{C}{{\text{H}}_{4}}$和$\text{C}{{\text{O}}_{2}}$,在一定条件下发生反应$\text{C}{{\text{H}}_{4}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g}),\text{C}{{\text{H}}_{4}}$的平衡转化率随温度、压强的变化关系如图所示。
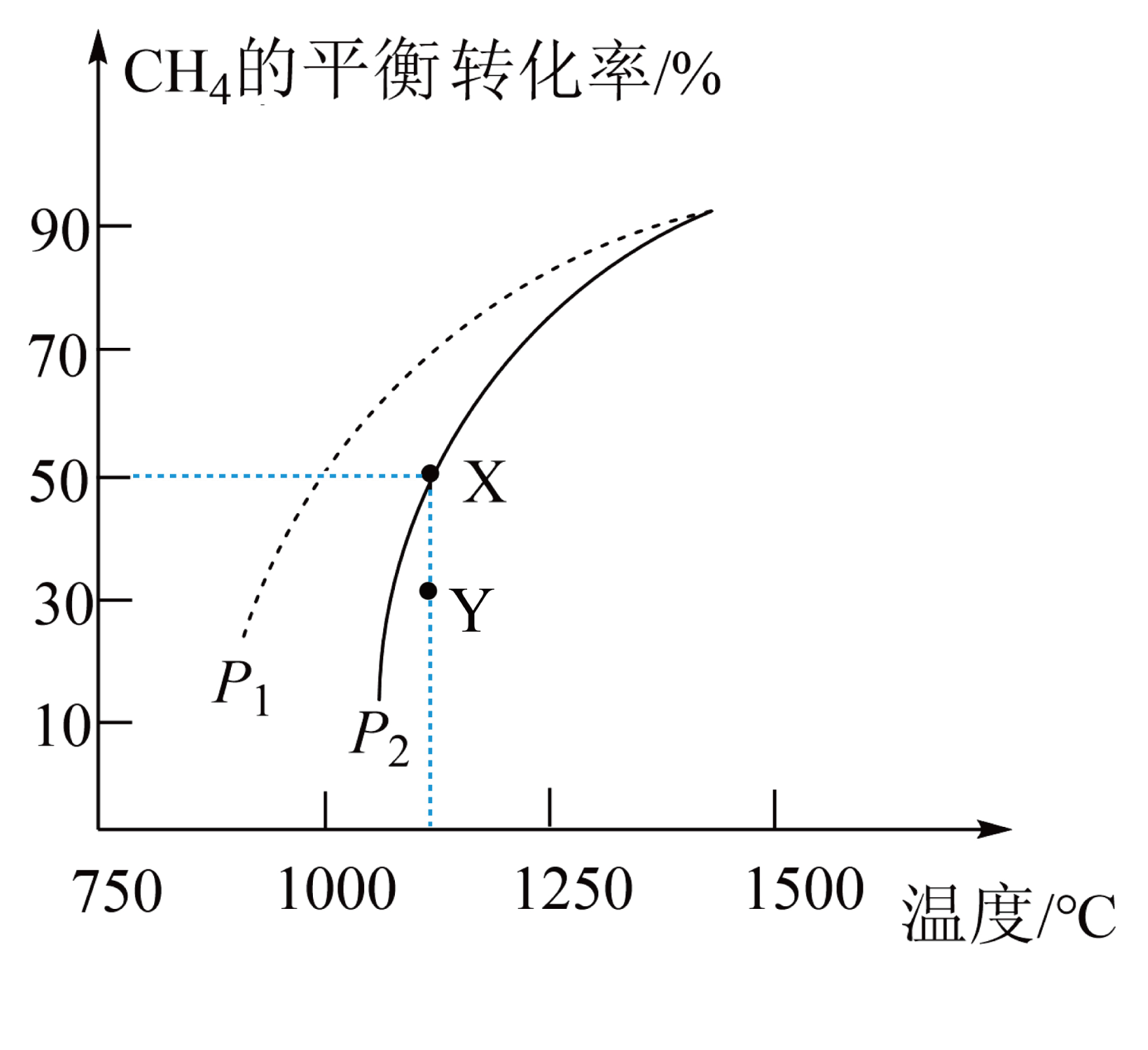
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是 $\rm ($填字母序号$\rm )$。
$\rm A$.容器中混合气体的密度保持不变
$\rm B$.容器内混合气体的压强保持不变
$\rm C$.反应速率:$2{{v}_{正}}\left( \text{C}{{\text{O}}_{2}} \right)={{v}_{正}}\left( {{\text{H}}_{2}} \right)$
$\rm D$.同时断裂$2\text{ mol C}-\text{H}$键和$1\text{ mol H}-\text{H}$键
②由图可知,压强${{P}_{1}}$ ${{P}_{2}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”,下同$\rm )$;$\rm Y$点速率${{v}_{正}}$ ${{v}_{逆}}$。
③反应经$t\text{ min}$达到$\rm X$点平衡状态,用$\text{C}{{\text{O}}_{\text{2}}}$表示反应速率为 ;若相同温度下,向密闭容器中充入$\text{0}\text{.01 mol/L,0}\text{.02 mol/L,0}\text{.01 mol/L,0}\text{.02 mol/L}$的$\text{C}{{\text{H}}_{\text{4}}}、\text{C}{{\text{O}}_{\text{2}}}、\text{CO}、{{\text{H}}_{\text{2}}}$,此时该反应处于 $\rm ($填“正向进行”、“逆向进行”、“化学平衡”$\rm )$状态。
$\\rm BD$ ; $\\rm \\lt $ ; $\\rm \\gt $ ; $\\dfrac{0.05}{t}\\text{ mol}\\cdot {{\\text{L}}^{-1}}\\cdot \\text{mi}{{\\text{n}}^{-1}}$ ; 正向进行
"]]①$\rm A$.反应前后气体总质量不变、容器体积不变,密度是恒量,容器中混合气体的密度保持不变,反应不一定平衡,故不选$\rm A$;
$\rm B$.反应后气体物质的量增大,压强是变量,容器内混合气体的压强保持不变,反应一定达到平衡状态,故选:$\rm B$;
$\rm C$.反应速率$2{{v}_{正}}\left( \text{C}{{\text{O}}_{2}} \right)={{v}_{正}}\left( {{\text{H}}_{2}} \right)$ ,不能判断正逆反应速率是否相等,反应不一定平衡,故不选$\rm C$;
$\rm D$.同时断裂$2\text{ mol C}-\text{H}$键和$1\text{ mol H}-\text{H}$键,正逆反应速率相等,反应一定达到平衡状态,故选:$\rm D$;
选$\rm BD$。
②增大压强平衡逆向移动,甲烷的平衡转化率降低,由图可知,压强${{P}_{1}}\lt {{P}_{2}}$;$\rm Y$点甲烷的转化率小于平衡状态甲烷的转化率,$\rm Y$点反应正向进行,$\rm Y$点速率${{v}_{正}}\gt {{v}_{逆}}$。
③反应经$t\text{ min}$达到$\rm X$点平衡状态,$\rm X$点甲烷的转化率为$\rm 50\%$
$\begin{matrix} {} & \text{C}{{\text{H}}_{4}}(\text{g}) & + & \text{C}{{\text{O}}_{2}}(\text{g}) & \rightleftharpoons & 2\text{CO}(\text{g}) & + & 2{{\text{H}}_{2}}(\text{g}) \\初始 \left( \text{mol/L} \right) & 0.1 & {} & 0.1 & {} & 0 & {} & 0 \\ 转化\left( \text{mol/L} \right) & 0.05 & {} & 0.05 & {} & 0.1 & {} & 0.1 \\平衡 \left( \text{mol/L} \right) & 0.05 & {} & 0.05 & {} & 0.1 & {} & 0.1 \\ \end{matrix}$
用$\text{C}{{\text{O}}_{\text{2}}}$表示反应速率为$\dfrac{0.0\text{5 mol/L}}{t\text{ }\min }=\dfrac{0.05}{t}\text{ mol}\cdot {{\text{L}}^{-1}}\cdot {{\min }^{-1}}$;$K=\dfrac{{{0.1}^{2}}\times {{0.1}^{2}}}{0.05\times 0.05}=0.04$,若相同温度下,向密闭容器中充入$\text{0}\text{.01 mol/L,0}\text{.02 mol/L,0}\text{.01 mol/L,0}\text{.02 mol/L}$的$\text{C}{{\text{H}}_{\text{4}}}、\text{C}{{\text{O}}_{\text{2}}}、\text{CO}、{{\text{H}}_{\text{2}}}$,$Q=\dfrac{{{0.01}^{2}}\times {{0.01}^{2}}}{0.01\times 0.02}=0.00005\lt K$,此时该反应处于正向进行”、“逆向进行状态。
同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生$\text{C}{{\text{H}}_{\text{4}}}-\text{C}{{\text{O}}_{\text{2}}}$重整反应,获得如下数据:
| 容器编号 | 起始时各物质的物质的量$\rm /\text{mol}$ | $\text{C}{{\text{H}}_{\text{4}}}$平衡转化率 | 达到平衡时体系能量的变化 | |||
| $\text{C}{{\text{H}}_{\text{4}}}$ | $\text{C}{{\text{O}}_{\text{2}}}$ | $\text{CO}$ | ${{\text{H}}_{\text{2}}}$ | |||
| $\rm i$ | $\rm 1$ | $\rm 2$ | $\rm 0$ | $\rm 0$ | 吸收热量:$\text{123}\text{.5 kJ}$ | |
| $\rm ii$ | $\rm 2$ | $\rm 4$ | $\rm 0$ | $\rm 0$ | $\rm \alpha$ | |
①容器$\rm ii$中反应达到平衡状态过程中吸收的热量 $\text{247 kJ}\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
②容器$\rm i$的容积变为原来的一半,则$\text{C}{{\text{H}}_{\text{4}}}$平衡转化率 $\alpha\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm \\lt $ ; $\\rm =$
"]]①容器$\rm ii$投料为容器$\rm i$的$\rm 2$倍,容器$\rm ii$压强大,平衡逆向移动,容器$\rm ii$中生成物的物质的量小于容器$\rm i$的$\rm 2$倍,反应达到平衡状态过程中吸收的热量$\lt \text{247 kJ}$。
②容器$\rm i$的容积变为原来的一半,与容器$\rm ii$为等效平衡,则$\text{C}{{\text{H}}_{\text{4}}}$平衡转化率$\rm =\alpha$。
高中 | 化学平衡常数题目答案及解析(完整版)
