高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
以黄铜矿$\rm ($主要成分为$\text{CuFe}{{\text{S}}_{2}}\rm )$为原料,用${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$溶液作浸取剂提取铜。
已知:ⅰ。${{\text{S}}_{2}}{{\text{O}}_{8}}^{2-}$的结构式为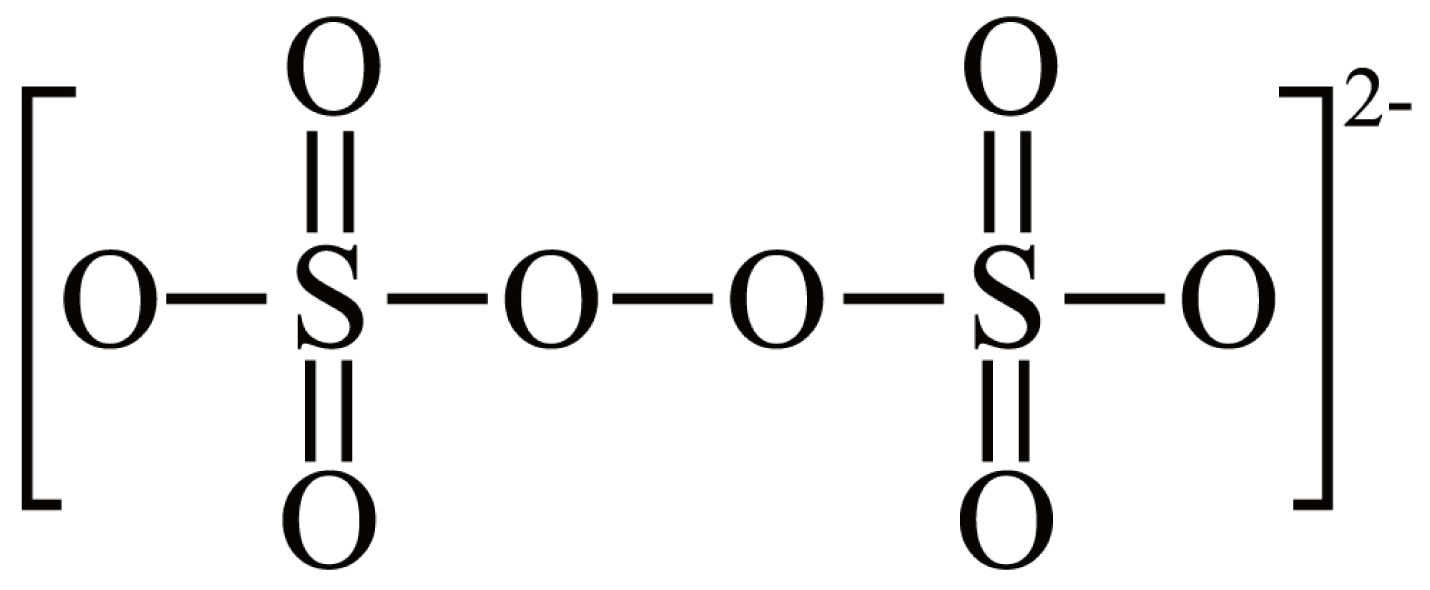 。
。
ⅱ。$\text{CuFe}{{\text{S}}_{2}}$、$\text{A}{{\text{g}}_{2}}\text{S}$均能导电。
${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$有强氧化性,用${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$溶液作浸取剂浸出$\text{CuFe}{{\text{S}}_{2}}$的原理示意图如下。
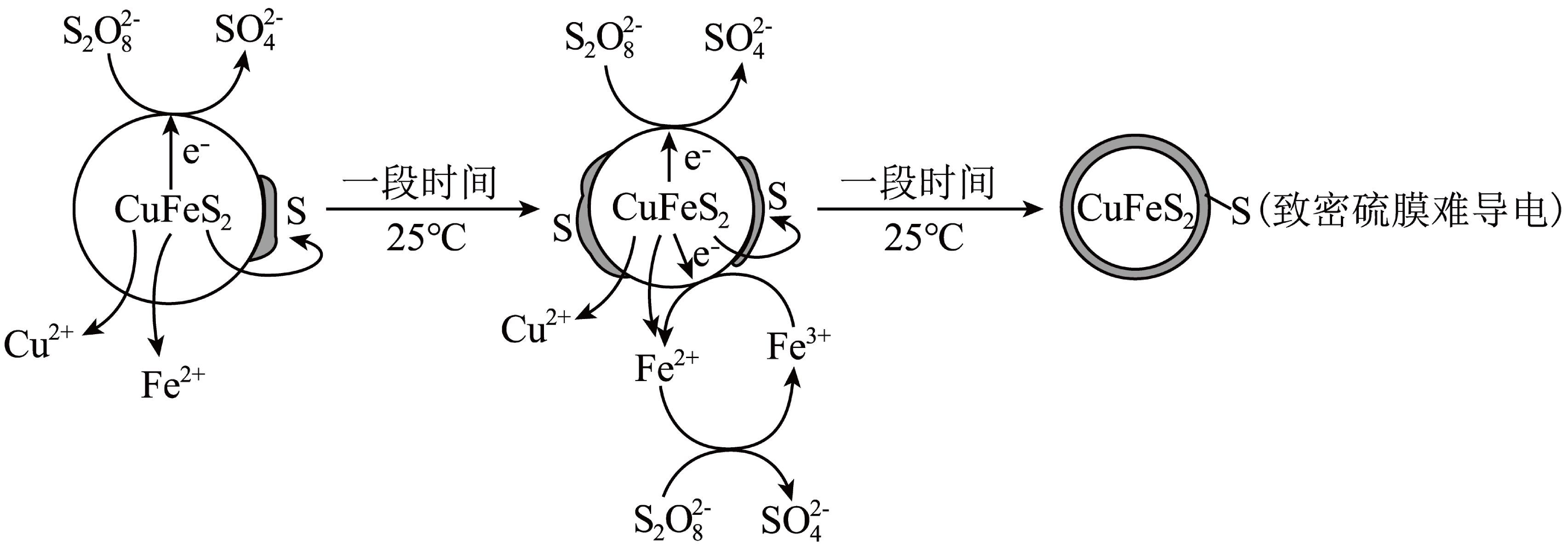
①正极的电极反应式为 。
②浸取初期,随着浸泡时间延长,$\text{C}{{\text{u}}^{2+}}$的浸出速率提高。可能的原因是 。
${{\\text{S}}_{\\text{2}}}\\text{O}_{\\text{8}}^{\\text{2-}}\\text{+2}{{\\text{e}}^{-}}\\text{=2SO}_{\\text{4}}^{\\text{2-}}$ ; 随着浸泡时间延长,生成的$\\rm Fe^{2+}$增多,$\\rm Fe^{2+}$作催化剂对$\\rm Cu^{2+}$浸出速率的影响大于$c\\left[ {{\\left( \\text{N}{{\\text{H}}_{\\text{4}}} \\right)}_{\\text{2}}}{{\\text{S}}_{\\text{2}}}{{\\text{O}}_{\\text{8}}} \\right]$减小对$\\rm Cu^{2+}$浸出速率的影响,从而使$\\rm Cu^{2+}$的浸出速率提高
"]]①由图可知正极${{\text{S}}_{2}}\text{O}_{8}^{2-}$得电子生成硫酸根离子,电极反应式为:${{\text{S}}_{\text{2}}}\text{O}_{\text{8}}^{\text{2-}}\text{+2}{{\text{e}}^{-}}\text{=2SO}_{\text{4}}^{\text{2-}}$
②随着浸泡时间延长,生成的$\rm Fe^{2+}$增多,$\rm Fe^{2+}$作催化剂对$\rm Cu^{2+}$浸出速率的影响大于$c\left[ {{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{8}}} \right]$减小对$\rm Cu^{2+}$浸出速率的影响,从而使$\rm Cu^{2+}$的浸出速率提高;
在足量${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$溶液中添加少量$\text{AgN}{{\text{O}}_{3}}$溶液作为浸取剂与$\text{CuFe}{{\text{S}}_{2}}$作用,一段时间结果如下:
| 添加$\text{A}{{\text{g}}^{+}}$ | 未加$\text{A}{{\text{g}}^{+}}$ | |
| $\text{Cu}$元素的浸出率 | $98.02\%$ | $30.90\%$ |
| 过程中产物形态 |  |  |
①结合离子方程式解释添加$\text{A}{{\text{g}}^{+}}$可以显著提高$\text{Cu}$元素的浸出率的原因: 。
②进一步研究发现添加的少量$\text{A}{{\text{g}}^{+}}$可以多次循环使用,具有类似“催化剂”的作用。其中$\text{A}{{\text{g}}^{+}}$“再生”的离子方程式为: 。
添加$\\rm Ag^{+}$发生反应$\\rm CuFeS_{2}+4Ag^{+}=2Ag_{2}S+Cu^{2+}+Fe^{2+}$,所生成的$\\rm Ag_{2}S$夹杂在硫层中,提高其导电性,使$\\rm CuFeS_{2}$的浸出反应得以继续进行 ; ${{\\text{S}}_{\\text{2}}}\\text{O}_{\\text{8}}^{\\text{2-}}\\text{+A}{{\\text{g}}_{\\text{2}}}\\text{S=2A}{{\\text{g}}^{+}}\\text{+2SO}_{\\text{4}}^{\\text{2-}}\\text{+S}$
"]]①添加$\rm Ag^{+}$发生反应$\rm CuFeS_{2}+4Ag^{+}=2Ag_{2}S+Cu^{2+}+Fe^{2+}$,所生成的$\rm Ag_{2}S$夹杂在硫层中,提高其导电性,使$\rm CuFeS_{2}$的浸出反应得以继续进行;
②$\rm Ag^{+}$“再生”的离子方程式为:${{\text{S}}_{\text{2}}}\text{O}_{\text{8}}^{\text{2-}}\text{+A}{{\text{g}}_{\text{2}}}\text{S=2A}{{\text{g}}^{+}}\text{+2SO}_{\text{4}}^{\text{2-}}\text{+S}$;
进一步从浸出液中提取铜并使${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$再生的流程示意图如下。
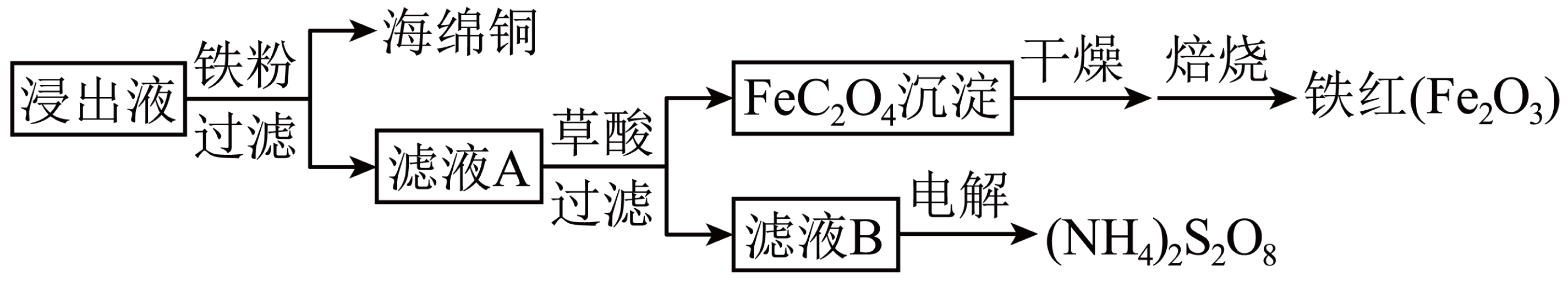
①在空气中焙烧$\text{Fe}{{\text{C}}_{2}}{{\text{O}}_{4}}$得到铁红,反应的化学方程式为 。
②由滤液$\rm B$电解$\rm (Pt$作电极$\rm )$生成${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$的总反应的离子方程式为 ;
③从能源及物质利用的角度,说明电解滤液$\rm B$而不直接电解滤液$\rm A$的优点: 。
$\\text{4Fe}{{\\text{C}}_{\\text{2}}}{{\\text{O}}_{\\text{4}}}\\text{+3}{{\\text{O}}_{\\text{2}}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{2F}{{\\text{e}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\text{+8C}{{\\text{O}}_{\\text{2}}}$ ; $\\text{2SO}_{\\text{4}}^{\\text{2-}}\\text{+2}{{\\text{H}}^{+}}\\begin{matrix} \\underline{\\underline{电解}} \\\\ {} \\\\ \\end{matrix}{{\\text{S}}_{\\text{2}}}\\text{O}_{\\text{8}}^{\\text{2-}}+{{\\text{H}}_{\\text{2}}}\\uparrow $ ; 直接电解滤液$\\rm B$可以避免电解时发生反应$\\rm Fe^{2+}-e^{-}=Fe^{3+}$消耗电能,得到更为纯净的$\\rm (NH_{4})_{2}S_{2}O_{8}$,同时获得铁红
"]]①在空气中焙烧$\rm FeC_{2}O_{4}$得到铁红,反应的化学方程式为: $\text{4Fe}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{+3}{{\text{O}}_{\text{2}}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{2F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{+8C}{{\text{O}}_{\text{2}}}$;
②由滤液$\rm B$电解$\rm (Pt$作电极$\rm )$生成$\rm (NH_{4})_{2}S_{2}O_{8}$的总反应的离子方程式为:$\text{2SO}_{\text{4}}^{\text{2-}}\text{+2}{{\text{H}}^{+}}\begin{matrix} \underline{\underline{电解}} \\ {} \\ \end{matrix}{{\text{S}}_{\text{2}}}\text{O}_{\text{8}}^{\text{2-}}+{{\text{H}}_{\text{2}}}\uparrow $;
③从能源及物质利用的角度,电解滤液$\rm B$而不直接电解滤液$\rm A$的优点:直接电解滤液$\rm B$可以避免电解时发生反应$\rm Fe^{2+}-e^{-}=Fe^{3+}$消耗电能,得到更为纯净的$\rm (NH_{4})_{2}S_{2}O_{8}$,同时获得铁红。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
