高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
氨和硝酸是重要的化工原料。合成氨及氨氧化制硝酸的工艺流程如下。
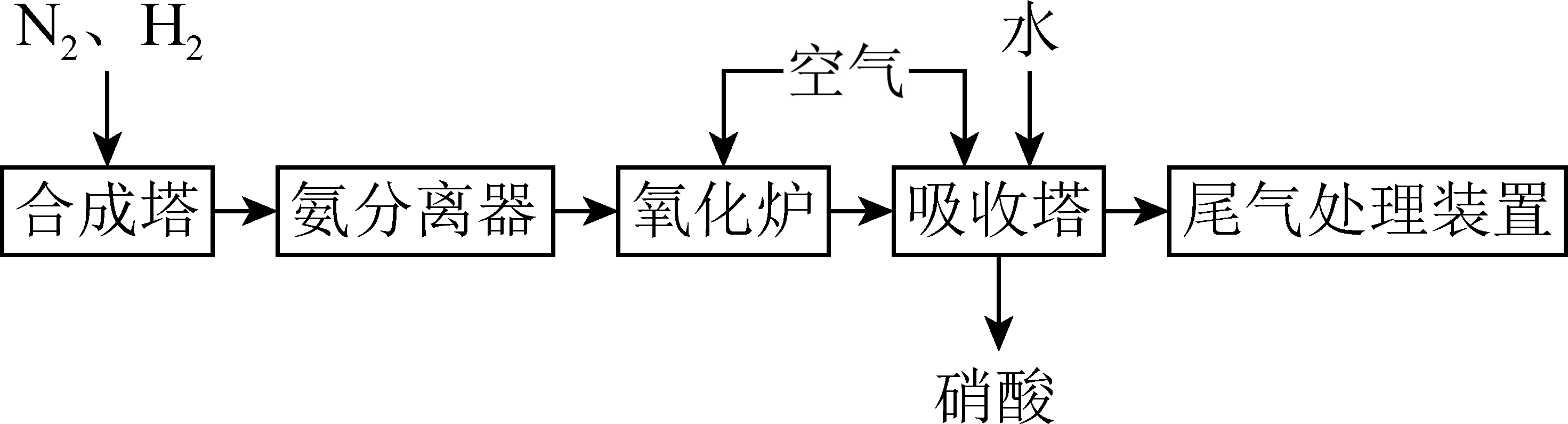
合成塔中,${{\text{N}}_{2}}$与${{\text{H}}_{2}}$反应生成$\text{N}{{\text{H}}_{3}}$。$\text{N}{{\text{H}}_{3}}$中氮元素的化合价为 。在该反应中,氧化剂是 $\rm ($填化学式,下同$\rm )$,被氧化的是 。
$\\rm -3$;${{\\text{N}}_{2}}$;${{\\text{H}}_{2}}$
"]]合成塔中,${{\text{N}}_{2}}$与${{\text{H}}_{2}}$反应生成$\text{N}{{\text{H}}_{3}}$ :${{\text{N}}_{\text{2}}}\text{+3}{{\text{H}}_{\text{2}}} \overset{催化剂 }{\underset{高温高压 }{\rightleftharpoons}} \text{2N}{{\text{H}}_{\text{3}}}$,$\text{N}{{\text{H}}_{3}}$中$\rm H$为$\rm +1$价,氮元素的化合价是$\rm -3$价。在该反应中,氮元素化合价降低,则氧化剂的化学式是${{\text{N}}_{2}}$,氢元素化合价升高,则被氧化的物质是${{\text{H}}_{2}}$。
氧化炉中,$\text{N}{{\text{H}}_{3}}$转化为$\rm NO$。通入空气是为了提供 $\rm ($填化学式$\rm )$。
${{\\text{O}}_{2}}$
"]]氧化炉中,$\text{N}{{\text{H}}_{3}}$转化为$\rm NO$,化学方程式为:$\text{4N}{{\text{H}}_{\text{3}}}\text{+5}{{\text{O}}_{\text{2}}}\begin{array}{*{20}{c}}{\underline{\underline {催化剂}} }\\{\triangle}\end{array}\text{4NO+6}{{\text{H}}_{\text{2}}}\text{O}$,则通入空气是为了提供${{\text{O}}_{2}}$ $\rm ($填化学式$\rm )$。
吸收塔中,$\rm NO$最终可转化为$\text{HN}{{\text{O}}_{3}}$。补全该过程中总反应的化学方程式:
$\text{NO}+$ $\mathrm{O}_{2}+$ ${{\text{H}}_{2}}\text{O}=$ $\text{HN}{{\text{O}}_{3}}$
$4 \\mathrm{NO}+3 \\mathrm{O}_{2}+2 \\mathrm{H}_{2} \\mathrm{O}=4 \\mathrm{HNO}_{3}$
"]]吸收塔中,$\rm NO$最终可转化为$\text{HN}{{\text{O}}_{3}}$。反应中,氮元素从$\rm +2$价升高到$\rm +5$价、氧气中氧元素从$\rm 0$价降低到$\rm -2$价,则按得失电子数守恒、元素质量守恒得:补全的该过程中总反应的化学方程式:$4 \mathrm{NO}+3 \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O}=4 \mathrm{HNO}_{3}$。
尾气处理装置中,可用$\text{N}{{\text{H}}_{3}}$将尾气中的$\text{N}{{\text{O}}_{2}}$还原为${{\text{N}}_{2}}$,同时生成${{\text{H}}_{2}}\text{O}$。若反应中还原了$\rm 46$ $\rm g$ $\text{N}{{\text{O}}_{2}}$,则生成${{\text{H}}_{2}}\text{O}$的质量为 $\rm \;\rm g$。
$\\rm 36$
"]]尾气处理装置中,可用$\text{N}{{\text{H}}_{3}}$将尾气中的$\text{N}{{\text{O}}_{2}}$还原为${{\text{N}}_{2}}$,同时生成${{\text{H}}_{2}}\text{O}$。化学方程式为:$\text{8N}{{\text{H}}_{\text{3}}}+\text{6N}{{\text{O}}_{\text{2}}}=\text{7}{{\text{N}}_{\text{2}}}+\text{12}{{\text{H}}_{\text{2}}}\text{O}$,可见:二氧化氮是氧化剂被还原,反应中每有$\rm 6\times 46$ $\rm g$ $\text{N}{{\text{O}}_{2}}$被还原,就生成$\rm 12\times 18\;\rm g$ ${{\text{H}}_{2}}\text{O}$,若反应中还原$\rm 46$ $\rm g$ $\text{N}{{\text{O}}_{2}}$,则生成${{\text{H}}_{2}}\text{O}$的质量为$\rm 36\;\rm g$。
硝酸生产过程中的酸性硝酸盐废水,可用负载在磁性石墨烯上的纳米$\rm Fe$还原处理。该过程的部分转化机理如图所示,*表示物种被吸附在纳米$\rm Fe$表面。
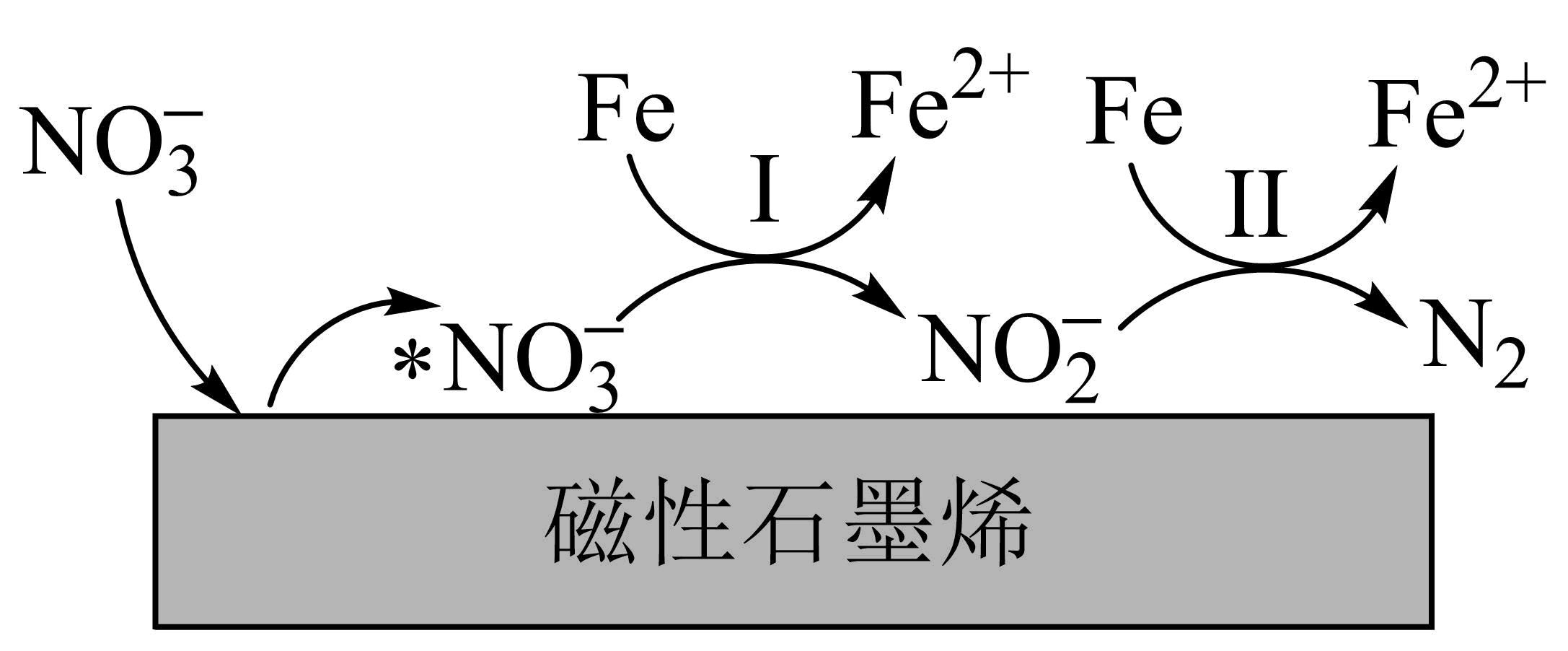
①转化Ⅰ中,纳米$\rm Fe$与$\text{NO}_{3}^{-}$反应的离子方程式为 。
②在碱性条件下,纳米$\rm Fe$处理$\text{NO}_{3}^{-}$的效果显著下降,一种可能的原因是 。
$\\text{Fe}+\\text{NO}_{3}^{-}+2{{\\text{H}}^{+}}=\\text{F}{{\\text{e}}^{2+}}+\\text{NO}_{2}^{-}+{{\\text{H}}_{2}}\\text{O}$;在碱性条件下,产生的$\\text{Fe}{{\\left( \\text{OH} \\right)}_{2}}$等沉淀附着在纳米$\\rm Fe$表面,阻碍了$\\text{NO}_{3}^{-}$吸附在纳米$\\rm Fe$表面被还原
"]]①由图:转化Ⅰ中,纳米$\rm Fe$与$\text{NO}_{3}^{-}$反应生成亚铁离子和亚硝酸根,反应中,铁元素从$\rm 0$价升高到$\rm +2$价、氮元素从$\rm +5$价降低到$\rm +3$价,则按得失电子数守恒、电荷守恒、元素质量守恒得:离子方程式为$\text{Fe}+\text{NO}_{3}^{-}+2{{\text{H}}^{+}}=\text{F}{{\text{e}}^{2+}}+\text{NO}_{2}^{-}+{{\text{H}}_{2}}\text{O}$。
②$\text{Fe}{{\left( \text{OH} \right)}_{2}}$是难溶物,则在碱性条件下,纳米$\rm Fe$处理$\text{NO}_{3}^{-}$的效果显著下降的可能的原因是:在碱性条件下,产生的$\text{Fe}{{\left( \text{OH} \right)}_{2}}$等沉淀附着在纳米$\rm Fe$表面,阻碍了$\text{NO}_{3}^{-}$吸附在纳米$\rm Fe$表面被还原。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
