高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
研究人员采用双极膜将酸$\rm -$碱电解液隔离,实现$\rm MnO_{2}/Mn^{2+}$和$\rm Zn/\text{Zn}(\text{OH})_{4}^{2-}$的两个溶解$\rm /$沉积电极氧化还原反应,研制出新型高比能液流电池,其放电过程原理示意图如下:
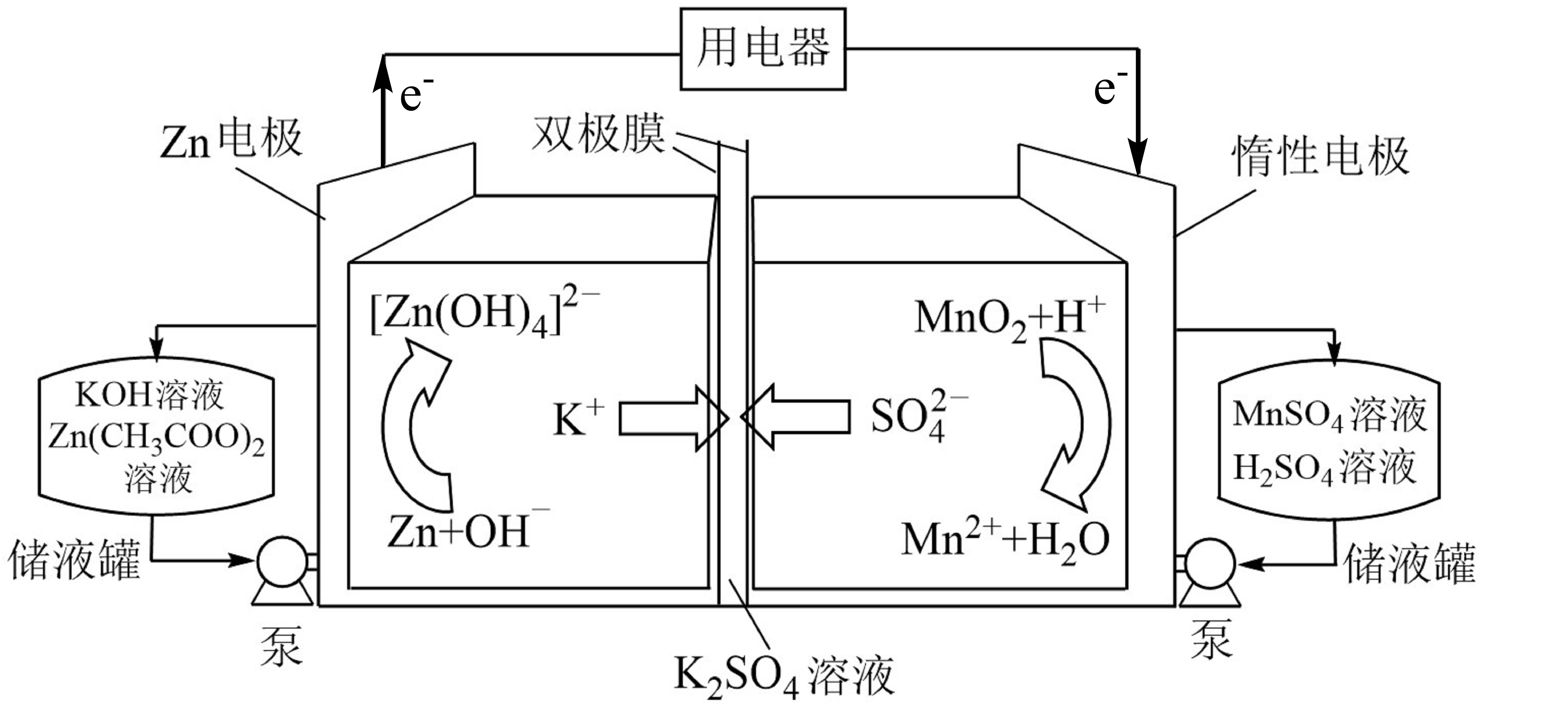
下列说法不正确的是$(\quad\ \ \ \ )$
放电过程中,总反应方程式为$\\rm Zn+MnO_{2}+4OH^{-}+4H^{+}=\\text{Zn}(\\text{OH})_{4}^{2-}\\rm +Mn^{2+}+2H_{2}O$
","放电过程中,当$\\rm 1$ $\\rm mol$ $\\rm Zn$参与反应时,理论上有$\\rm 4$ $\\rm mol$ $\\rm K^{+}$发生迁移
","充电过程中,阴极的电极反应为$\\text{Zn}(\\text{OH})_{4}^{2-}\\rm +2e^{-}=Zn+4OH^{-}$
","充电过程中,右侧池中溶液$\\rm pH$逐渐减小
"]分析:根据电池示意图,左侧$\rm Zn$失去电子与溶液中的$\rm OH^{-}$反应生成$\text{Zn}(\text{OH})_{4}^{2-}$,为负极反应,右侧$\rm MnO_{2}$得电子与溶液中的$\rm H^{+}$反应生成$\rm Mn^{2+}$和水;电解过程中,右侧的$\rm Mn^{2+}$失去电子与水反应生成$\rm MnO_{2}$和$\rm H^{+}$,电极方程式与原电池的正极方程式相反,左侧$\text{Zn}(\text{OH})_{4}^{2-}$得电子生成$\rm Zn$和$\rm OH^{-}$,电极方程式与原电池的负极方程式相反,据此分析。
$\rm A$.放电过程中负极的电极反应式为$\rm Zn-2e^{-}+4OH^{-}=\text{Zn}(\text{OH})_{4}^{2-}$,正极的电极方程式为$\rm MnO_{2}+2e^{-}+4H^{+}=Mn^{2+}+2H_{2}O$,总反应为$\rm Zn+MnO_{2}+4OH^{-}+4H^{+}=\text{Zn}(\text{OH})_{4}^{2-}\rm +Mn^{2+}+2H_{2}O$,$\rm A$正确;
$\rm B$.放电过程中每消耗$\rm 1$ $\rm mol$ $\rm Zn$会生成$\rm 1$ $\rm mol$ $\text{Zn}(\text{OH})_{4}^{2-}$,即每消耗$\rm 4$ $\rm mol$负电荷生成$\rm 2$ $\rm mol$负电荷,电解质中减少$\rm 2$ $\rm mol$负电荷,因此有$\rm 2$ $\rm mol$ $\rm K^{+}$发生迁移,$\rm B$错误;
$\rm C$.根据分析,充电过程中阴极的电极方程式与放电过程中负极的电极方程式相反,阴极的电极方程式为$\text{Zn}(\text{OH})_{4}^{2-}\rm +2e^{-}=Zn+4OH^{-}$,$\rm C$正确;
$\rm D$.充电过程中右侧$\rm Mn^{2+}$不断失去电子并结合水生成$\rm MnO_{2}$,同时生成大量$\rm H^{+}$,因此,右侧$\rm pH$不断减小,$\rm D$正确;
故选:$\rm B$
高中 | 原电池工作原理题目答案及解析(完整版)
