高中 | 化学反应热的计算 题目答案及解析
稿件来源:高途
高中 | 化学反应热的计算题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
化学反应热的计算
化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气$\rm ($主要成分为$\rm CO$、$\rm CO_{2}$和$\rm H_{2})$在催化剂的作用下合成甲醇$\rm (CH_{3}OH)$是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.$\rm CO$与$\rm H_{2}$反应合成甲醇
Ⅱ.$\rm CO_{2}$与$\rm H_{2}$反应合成甲醇$\rm CO_{2}(g)+3H_{2}(g)⇌CH_{3}OH(g)+H_{2}O(g)$
上述反应Ⅰ是原子经济性反应,写出化学反应方程式 。
$\\rm CO(g)+2H_{2}(g)\\overset{催化剂}{\\underset{}{\\rightleftharpoons}}CH_{3}OH(g)$
"]]上述反应Ⅰ是原子经济性反应,理想的原子经济反应是原料分子中的原子百分之百地转变成产物,不产生副产物或废物,实现废物的“零排放”,故化学反应方程式为:$\rm CO(g)+2H_{2}(g)\overset{催化剂}{\mathop{\rightleftharpoons }}\,CH_{3}OH(g)$。
在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是 $\rm ($填一项即可$\rm )$。
升温或增大压强
"]]提高上述反应Ⅱ的反应速率可以采用升温,加压等措施加快反应速率。
一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是 。
$\rm a$.单位时间消耗$n\ \rm mol\ CO_{2}$的同时,消耗$3n\ \rm mol$的$\rm H_{2}$
$\rm b$.容器内$\rm CH_{3}OH$的浓度不再改变
$\rm c$.容器内气体压强不再改变
$\rm d$.容器内气体密度不再改变
$\\rm bc$
"]]一定温度下,在容积固定的密闭容器中发生反应Ⅱ:$\rm CO_{2}(g)+3H_{2}(g)⇌CH_{3}OH(g)+H_{2}O(g)$
$\rm a$.单位时间消耗$n\ \rm mol\ CO_{2}$的同时,消耗$3n\ \rm mol$的$\rm H_{2}$,都表示正反应方向的速率,不能代表处于平衡状态,故$\rm a$不符合题意。
$\rm b$.反应发生时容器内$\rm CH_{3}OH$的浓度是一个变值,容器内$\rm CH_{3}OH$的浓度不再改变代表化学反应达到平衡状态,故$\rm b$符合题意。
$\rm c$.反应是一个气体分子数减小的反应,也是一个压强减小的反应,当容器内气体压强不再改变代表达到平衡状态,故$\rm c$符合题意。
$\rm d$.由于是在容积固定的密闭容器中,则气体的密度是一个定值,若容器内气体密度不再改变,不能代表反应达到平衡状态,故$\rm d$不符合题意。
生成$\rm 1\ mol\ CH_{3}OH$放出$a\ \rm kJ$的能量,反应Ⅰ中拆开$\rm 1\ mol$化学键所需的能量$(E)$的相关数据如下:
| 化学键 | $\rm H-H$ | $\rm C-O$ | $\rm CO$中的$\rm \ C\overset{\scriptscriptstyle\leftarrow}{=}O$ | $\rm H-O$ | $\rm C-H$ |
| $E\rm (kJ)$ | $m$ | $n$ | $E_{1}$ | $x$ | $y$ |
根据相关数据计算拆开$\rm 1\ mol\ C\overset{\scriptscriptstyle\leftarrow}{=}O$所需的能量$E_{1}=$ $\rm \ kJ$。
$-a+3y+n+x-2\\ m$
"]]生成$\rm 1\ mol\ CH_{3}OH$放出$a\ \rm kJ$的能量,反应Ⅰ为:$\rm CO(g)+2H_{2}(g)\overset{催化剂}{\underset{}{\rightleftharpoons}}CH_{3}OH(g)$,则反应物断裂化学键键能之和减去生成物形成化学键键能之和等于生成$\rm 1\ mol\ CH_{3}OH$放出的热量,得到的式子为:$E_{1}+2m-(3y+n+x)=-a$,得到$E_{1}=-a+3y+n+x-2m$。
$\rm H_{2}$还原$\rm CO_{2}$电化学法制备甲醇的工作原理如下图所示:
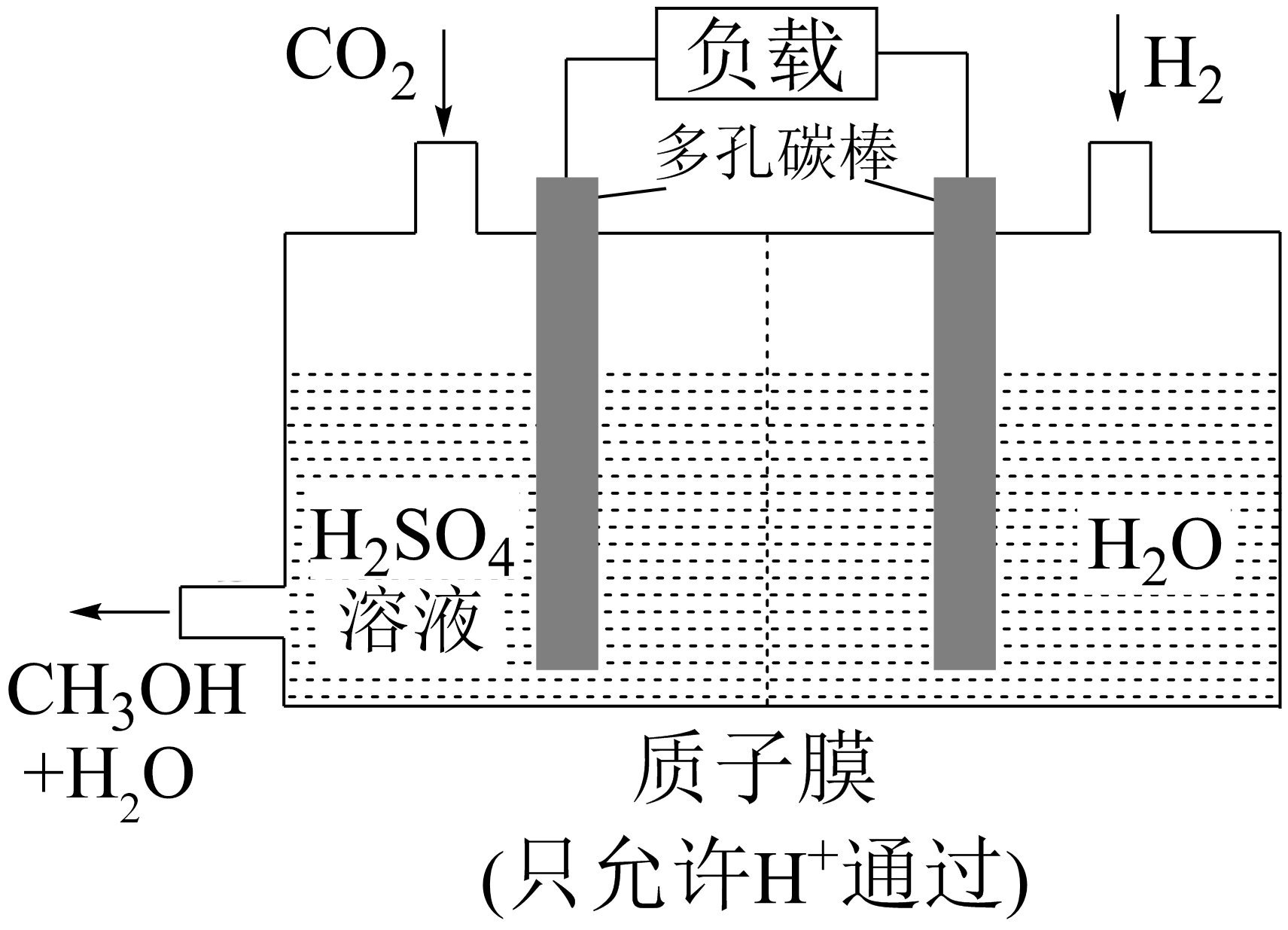
通入$\rm H_{2}$的一端是电池的 极$\rm ($填“正”或“负”$\rm )$,通入$\rm CO_{2}$的一端发生的电极反应式为 。
负;$\\rm CO_{2}+6H^{+}+6e^{-}=CH_{3}OH+H_{2}O$
"]]$\rm H_{2}$还原$\rm CO_{2}$电化学法制备甲醇的总反应为$\rm CO_{2}+3H_{2}=CH_{3}OH+H_{2}O$,二氧化碳的化合价降低,在正极上得电子,正极反应为:$\rm CO_{2}+6H^{+}+6e^{-}=CH_{3}OH+H_{2}O$,氢气的化合价升高,作负极,电极反应为$\rm 3H_{2}-6e^{-}=6H^{+}$。
高中 | 化学反应热的计算题目答案及解析(完整版)
