高中 | 化学反应热的计算 题目答案及解析
稿件来源:高途
高中 | 化学反应热的计算题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
化学反应热的计算
镁基储氢材料$\rm MgH_{2}$具有储氢量高、成本低廉等优点,发展前景广阔。
Ⅰ$\rm .MgH_{2}$热分解放出$\rm H_{2}$
${\rm MgH_{2}(s)Mg(s)+H_{2}(g)}\quad\Delta H=+75\rm \ kJ/mol$
该反应的能量变化如图。
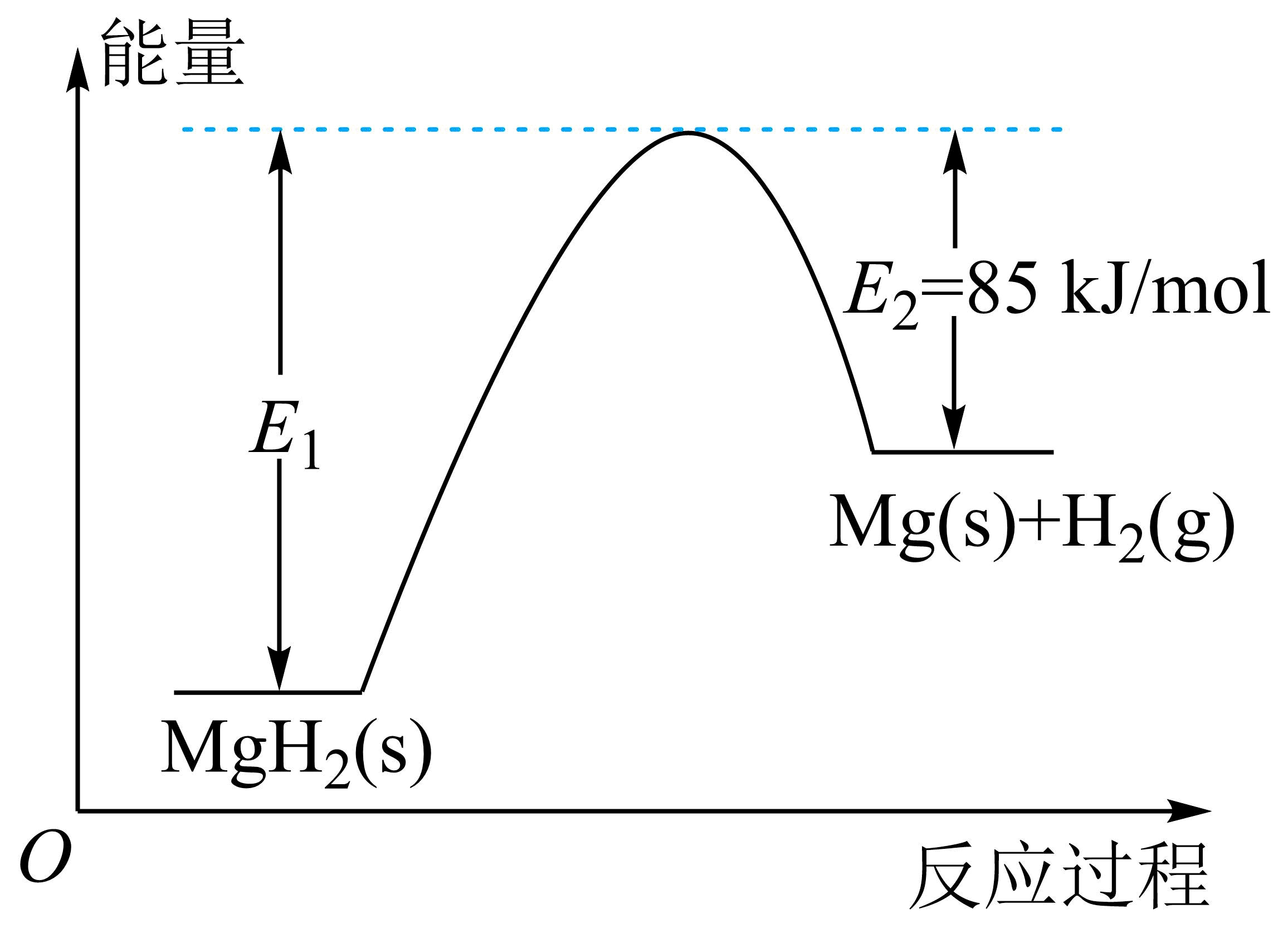
$E_{1}=$ 。
$\\rm 160\\ kJ/mol$
"]]焓变等于正反应的活化能减去逆反应的活化能,则$\Delta H=E_{1}-E_{2}=E_{1}-85\rm \ kJ/mol=+75\ kJ/mol$,解得$E_{1}=160\rm \ kJ/mol$。
提高$\rm H_{2}$平衡产率的措施有 $\rm ($答$\rm 2$条$\rm )$。
高温、低压、及时移走$\\rm H_{2}$
"]]该反应为体积增大的吸热反应,则提高$\rm H_{2}$平衡产率的措施有高温、低压、及时移走$\rm H_{2}$。
Ⅱ$\rm .MgH_{2}$水解制备$\rm H_{2}$
$\rm MgH_{2}$与$\rm H_{2}O$反应制备$\rm H_{2}$的化学方程式是 。
$\\rm MgH_{2}+2H_{2}O=Mg(OH)_{2}+2H_{2}↑$
"]]$\rm MgH_{2}$与$\rm H_{2}O$反应制备$\rm H_{2}$的化学方程式是$\rm MgH_{2}+2H_{2}O=Mg(OH)_{2}+2H_{2}↑$。
$\rm MgH_{2}$与$\rm H_{2}O$反应时,最初生成$\rm H_{2}$的速率很快,但随后变得很缓慢,原因是 。
产物$\\rm Mg(OH)_{2}$逐渐覆盖在$\\rm MgH_{2}$表面,减少了$\\rm MgH_{2}$与$\\rm H_{2}O$的接触面积
"]]$\rm MgH_{2}$与$\rm H_{2}O$反应时会生成氢氧化镁沉淀,附着在$\rm MgH_{2}$表面,故原因是产物$\rm Mg(OH)_{2}$逐渐覆盖在$\rm MgH_{2}$表面,减少了$\rm MgH_{2}$与$\rm H_{2}O$的接触面积。
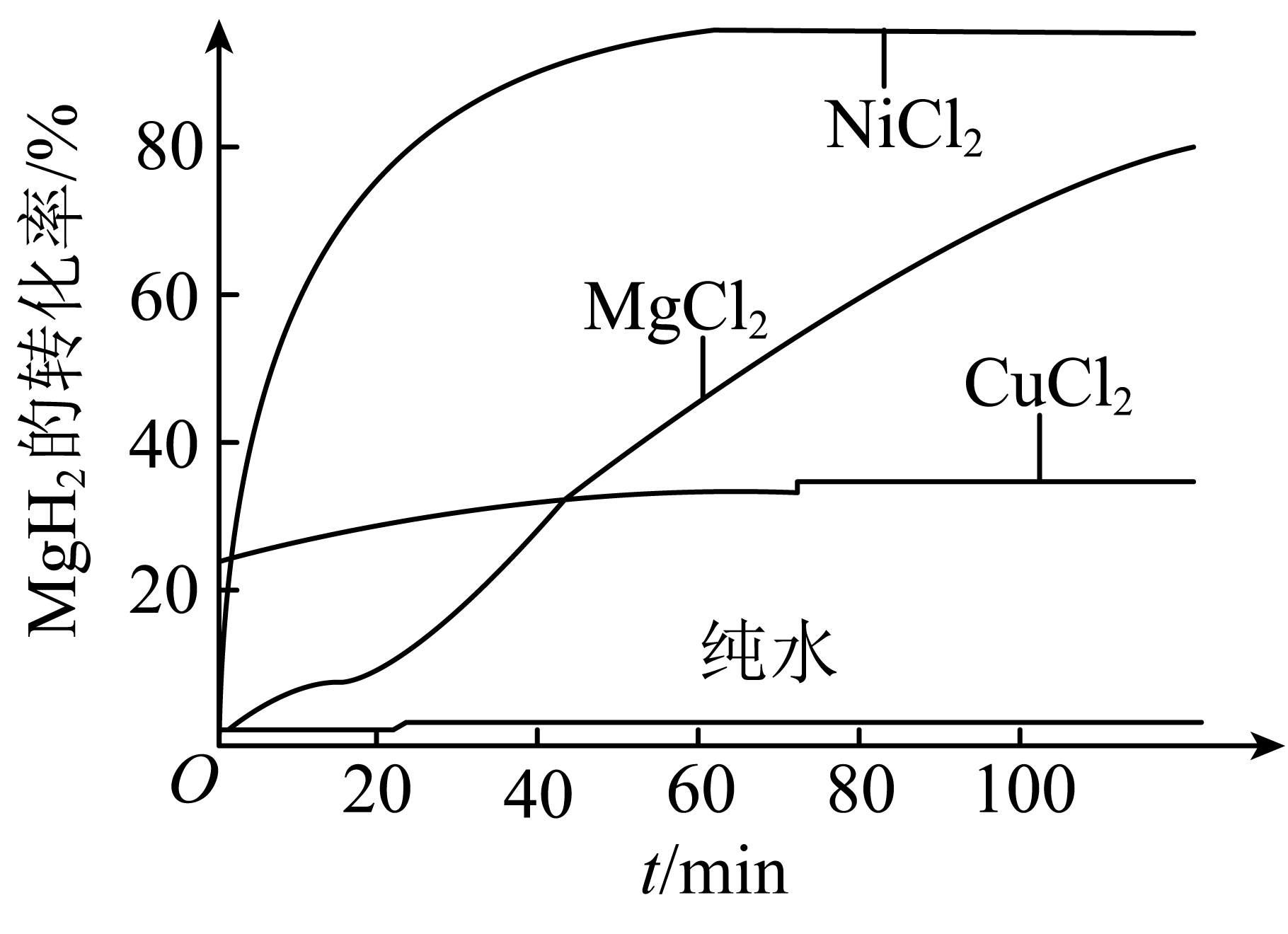
$\rm MgCl_{2}$、$\rm NiCl_{2}$、$\rm CuCl_{2}$等盐溶液能提升$\rm MgH_{2}$的水解性能。$\rm 1\ mol/L$的几种盐溶液对$\rm MgH_{2}$水解制备$\rm H_{2}$的性能曲线如图。
已知:ⅰ$\rm .$
| 物质 | $\rm Mg(OH)_{2}$ | $\rm Ni(OH)_{2}$ | $\rm Cu(OH)_{2}$ |
| $K_{\rm sp}$ | $\rm 5.6\times 10^{-12}$ | $\rm 5.5\times 10^{-16}$ | $\rm 2.2\times 10^{-20}$ |
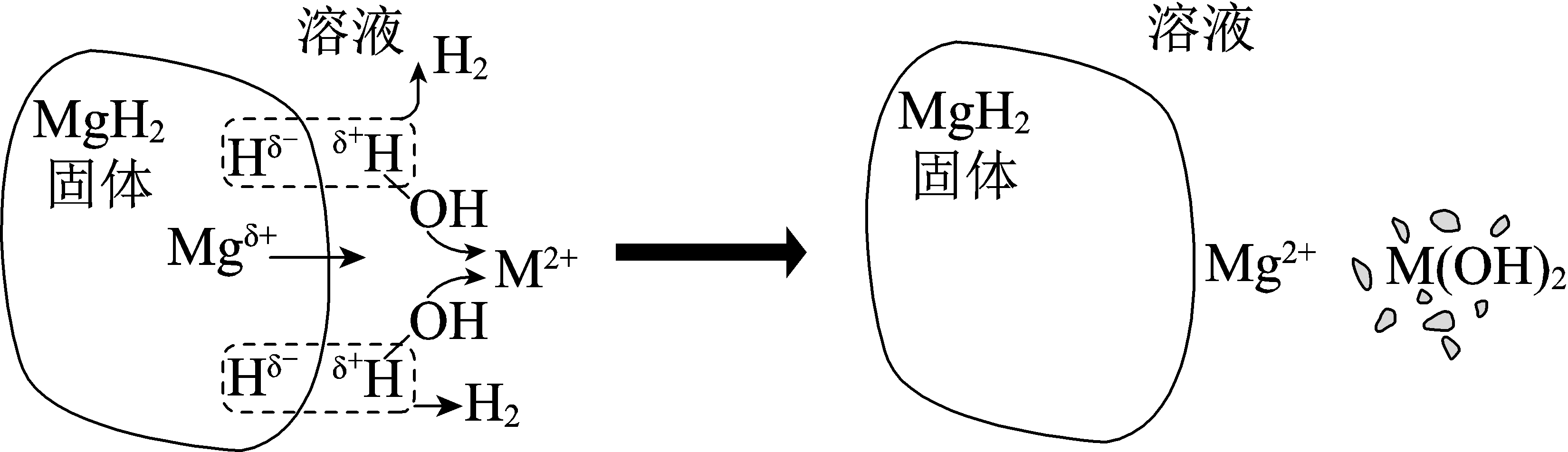
ⅱ$\rm .MgH_{2}$在$\rm MCl_{2}(M$代表$\rm Mg$、$\rm Ni$、$\rm Cu)$溶液中水解的示意图如图。
①$\rm NiCl_{2}$溶液制备$\rm H_{2}$的性能优于$\rm MgCl_{2}$溶液,原因是 。
②$\rm MgH_{2}$在$\rm MgCl_{2}$溶液中制备$\rm H_{2}$的性能不如在$\rm NiCl_{2}$溶液中优异,但使用$\rm MgCl_{2}$溶液利于发展“镁$\rm -$氢”循环经济,原因是 。
③$\rm CuCl_{2}$溶液制备$\rm H_{2}$的性能不如$\rm NiCl_{2}$溶液,可能的原因是 。
$K_{\\rm sp}{\\rm [Ni(OH)_{2}]}\\lt K_{\\rm sp}\\rm [Mg(OH)_{2})]$,$\\rm Ni^{2+}$结合$\\rm H_{2}O$电离的$\\rm OH^{-}$的能力强于$\\rm Mg^{2+}$,更有利于$\\rm H_{2}$的产生;反应后固体生成物仅有$\\rm Mg(OH)_{2}$,便于回收利用;分离除去$\\rm Mg(OH)_{2}$,可以循环使用$\\rm MgCl_{2}$溶液;$\\rm MgH_{2}$将$\\rm Cu^{2+}$还原为难溶固体覆盖在$\\rm MgH_{2}$表面,阻止反应持续发生
"]]①根据$K_{\rm sp}{\rm [Ni(OH)_{2}]}\lt K_{\rm sp}\rm [Mg(OH)_{2})]$,$\rm Ni^{2+}$更容易生成沉淀,故$\rm NiCl_{2}$溶液制备$\rm H_{2}$的性能优于$\rm MgCl_{2}$溶液,原因是$K_{\rm sp}{\rm [Ni(OH)_{2}]}\lt K_{\rm sp}\rm [Mg(OH)_{2})]$,$\rm Ni^{2+}$结合$\rm H_{2}O$电离的$\rm OH^{-}$的能力强于$\rm Mg^{2+}$,更有利于$\rm H_{2}$的产生。
②$\rm MgH_{2}$在$\rm MgCl_{2}$溶液中制备$\rm H_{2}$的性能不如在$\rm NiCl_{2}$溶液中优异,但使用$\rm MgCl_{2}$溶液利于发展“镁$\rm -$氢”循环经济,原因是反应后固体生成物仅有$\rm Mg(OH)_{2}$,便于回收利用;分离除去$\rm Mg(OH)_{2}$,可以循环使用$\rm MgCl_{2}$溶液。
③铜离子具有较强的氧化性,而$\rm MgH_{2}$具有较强的还原性,故$\rm CuCl_{2}$溶液制备$\rm H_{2}$的性能不如$\rm NiCl_{2}$溶液,可能的原因是$\rm MgH_{2}$将$\rm Cu^{2+}$还原为难溶固体覆盖在$\rm MgH_{2}$表面,阻止反应持续发生。
高中 | 化学反应热的计算题目答案及解析(完整版)
