| 配合物理论 题目答案及解析
稿件来源:高途
| 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
铜及其化合物具有广泛的用途。
$\rm ($一$\rm )\text{C}{{\text{u}}_{2}}\text{O}$广泛应用于太阳能电池领域。以$\text{CuS}{{\text{O}}_{4}}$、$\text{NaOH}$和抗坏血酸为原料,可制备$\text{C}{{\text{u}}_{2}}\text{O}$。
$\text{C}{{\text{u}}^{2+}}$基态核外电子排布式为 。
$[\\!\\!\\text{ Ar }\\!\\!]\\!\\!\\text{ 3}{{\\text{d}}^{\\text{10}}}$或$\\text{1}{{\\text{s}}^{\\text{2}}}\\text{2}{{\\text{s}}^{\\text{2}}}\\text{2}{{\\text{p}}^{\\text{6}}}\\text{3}{{\\text{s}}^{\\text{2}}}\\text{3}{{\\text{p}}^{\\text{6}}}\\text{3}{{\\text{d}}^{\\text{10}}}$
"]]$_{29}\text{Cu}$基态核外电子排布式为$\text{ }\!\![\!\!\text{ Ar }\!\!]\!\!\text{ 3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$或$\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{6}}}\text{3}{{\text{s}}^{\text{2}}}\text{3}{{\text{p}}^{\text{6}}}\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$,$\text{C}{{\text{u}}^{2+}}$基态核外电子排布式为$\text{ }\!\![\!\!\text{ Ar }\!\!]\!\!\text{ 3}{{\text{d}}^{\text{10}}}$或$\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{6}}}\text{3}{{\text{s}}^{\text{2}}}\text{3}{{\text{p}}^{\text{6}}}\text{3}{{\text{d}}^{\text{10}}}$;
抗坏血酸的分子结构如图$\rm 1$所示。推测抗坏血酸在水中的溶解性: $\rm ($填“难溶于水”或“易溶于水”$\rm )$,理由是: 。
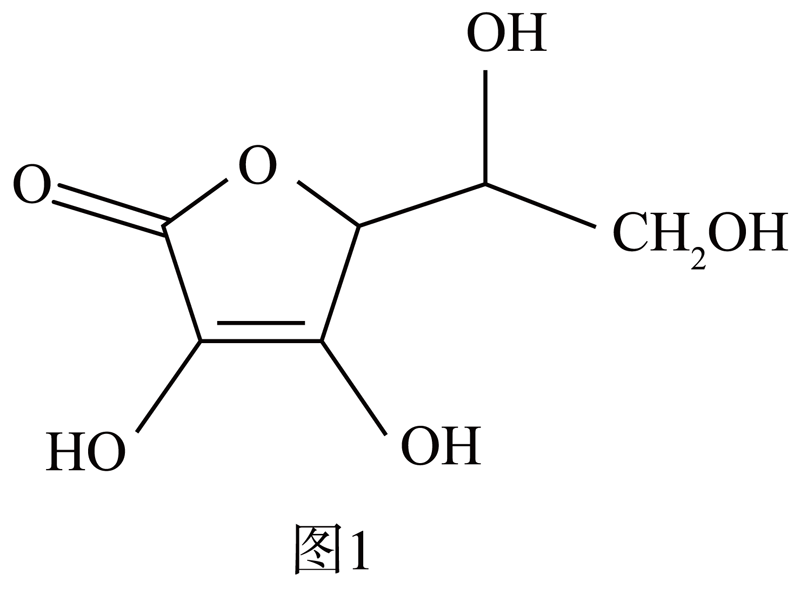
易溶于水;分子中含有$\\rm 4$个$\\rm -OH$,能与水形成分子间氢键
"]]根据抗环血酸分子结构,分子中含有$\rm 4$个$\rm -OH$,能与水形成分子间氢键,因此抗坏血酸易溶于水;
一个$\text{C}{{\text{u}}_{2}}\text{O}$晶胞$\rm ($见图$\rm 2)$中,晶胞中$\text{C}{{\text{u}}^{+}}$离子的数目为 。
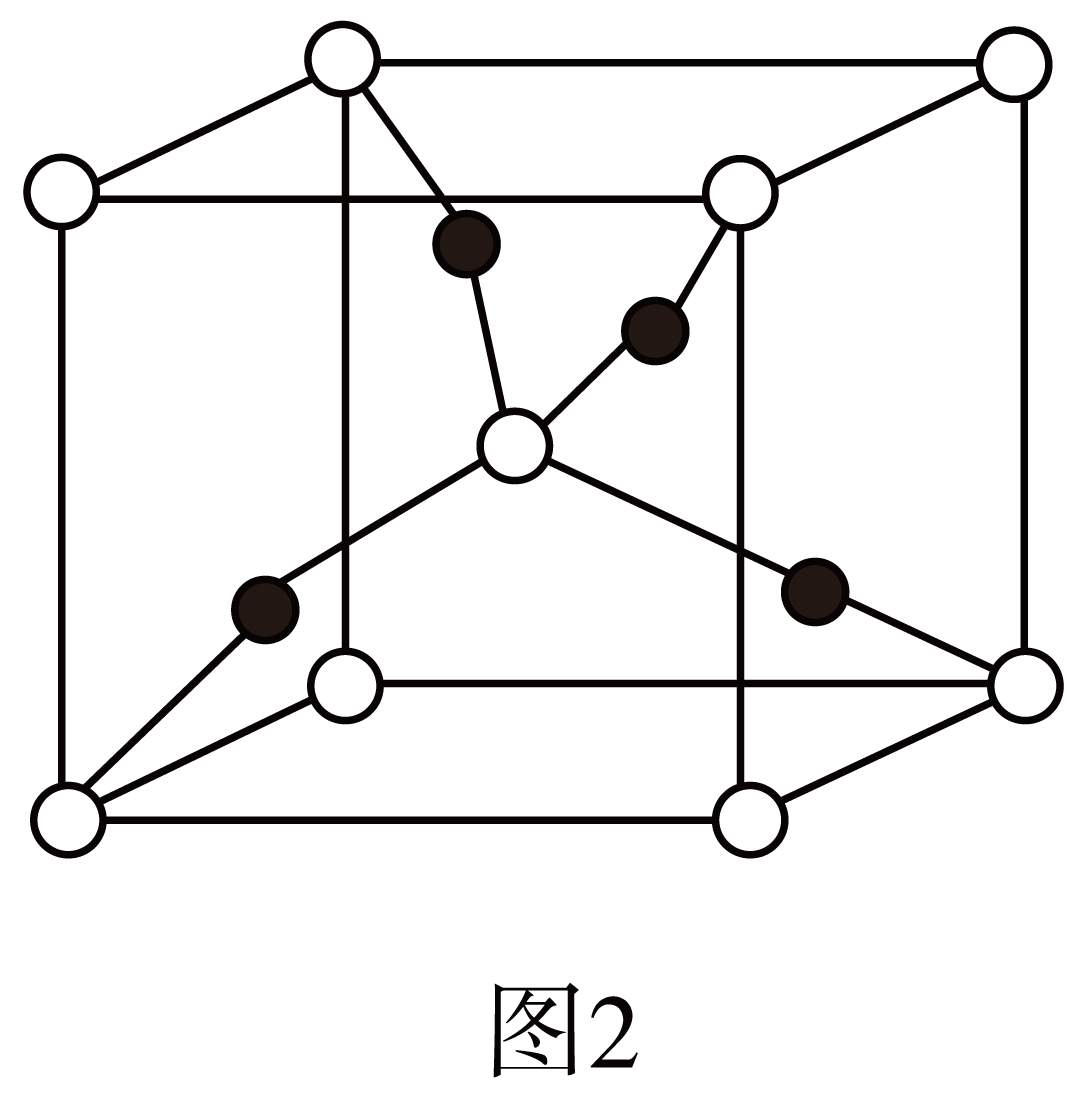
$\\rm 4$
"]]根据$\text{C}{{\text{u}}_{2}}\text{O}$晶胞,顶点为氧离子,晶胞内部为$\text{C}{{\text{u}}^{+}}$,晶胞中$\text{C}{{\text{u}}^{+}}$离子的数目为$\rm 4$。
两种离子晶体$\text{C}{{\text{u}}_{2}}\text{O}$和$\text{C}{{\text{u}}_{2}}\text{S}$的熔点比较,熔点较高的是 ,解释原因 。
$\\rm Cu_{2}O$;$\\rm Cu_{2}O$、$\\rm Cu_{2}S$都是离子晶体,$\\rm O^{2-}$半径比$\\rm S^{2-}$半径小,阴阳离子的核间距越小,晶格能越大,熔点越高
"]]两种离子晶体$\rm Cu_2O$和$\rm Cu_2S$的熔点比较,$\rm Cu_{2}O$、$\rm Cu_{2}S$都是离子晶体,$\rm O^{2-}$半径比$\rm S^{2-}$半径小,阴阳离子的核间距越小,晶格能越大,熔点越高,故$\rm Cu_{2}O$的熔点较高;
$\rm ($二$\rm )\text{Cu}$是叶绿素的必要成分,叶绿素的结构如图$\rm 3$,请回答相关问题:
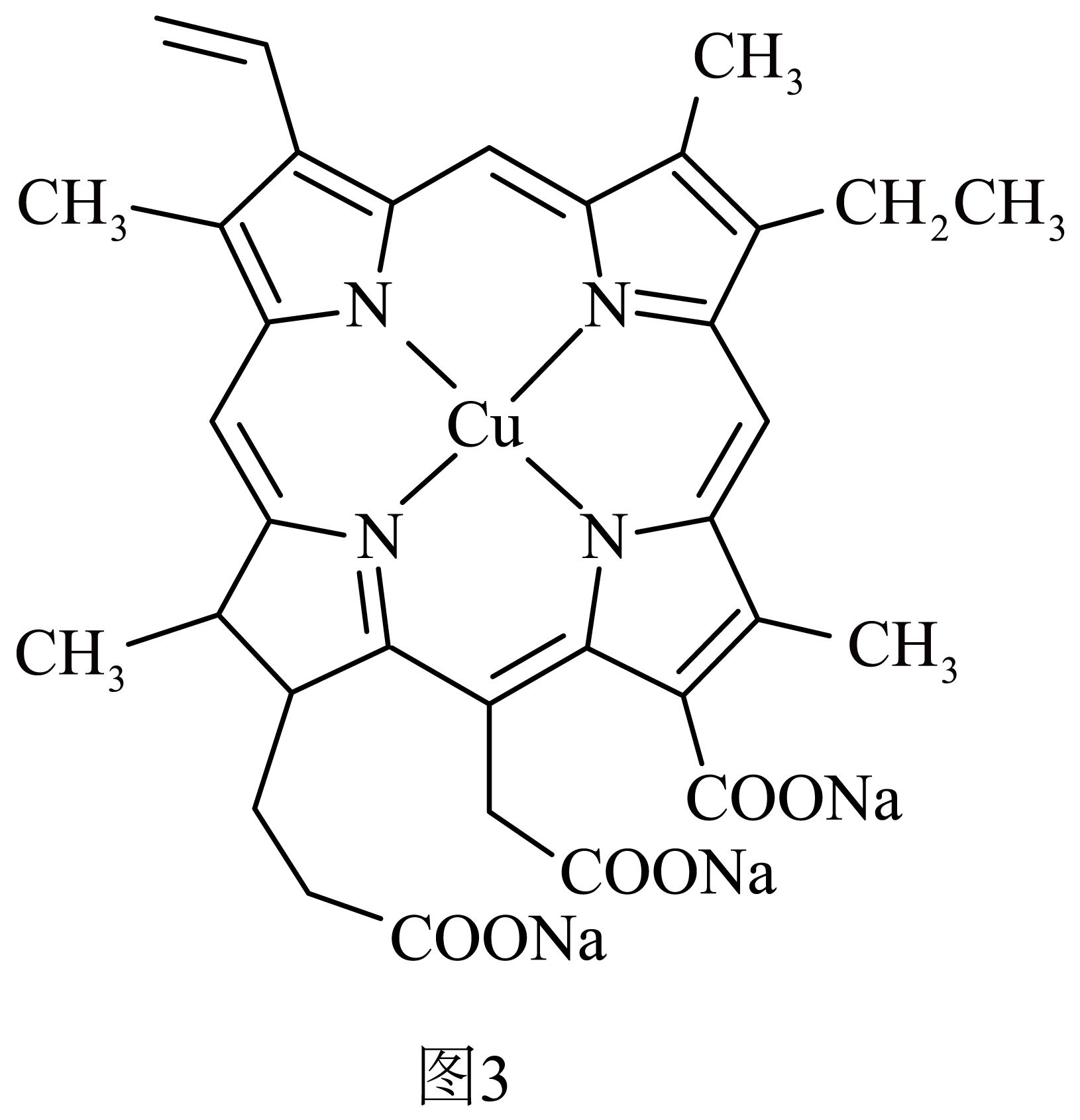
在叶绿素中,$\text{C}{{\text{u}}^{2+}}$与$\text{N}$原子之间形成的化学键称为 。
配位键
"]]$\text{C}{{\text{u}}^{2+}}$与$\text{N}$原子之间形成的化学键称为配位键;
构成叶绿素的非金属元素中,$\text{N}$和$\mathrm{O}$第一电离能较大的为 ,请从原子结构角度解释原因 。
$\\rm N$;$\\rm N$原子$\\rm 2p$轨道半充满,第一电离能高于$\\rm O$
"]]同周期主族元素的第一电离能,随着原子序数的增大,有增大的趋势,由于$\rm N$原子$\rm 2p$轨道半充满,第一电离能高于$\rm O$,则第一电离能较大的为$\rm N$。
| 配合物理论题目答案及解析(完整版)
