| 配合物理论 题目答案及解析
稿件来源:高途
| 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
资料表明$\rm Co^{2+}$还原性很弱,某小组同学为实现$\overset{+2}{\mathop{\text{Co}}}\,\to \overset{+3}{\mathop{\text{Co}}}\,$,进行如下探究。
理论分析:氧化半反应$\text{C}{{\text{o}}^{2+}}-{{\text{e}}^{-}}=\text{C}{{\text{o}}^{3+}}$一般很难发生。从平衡移动的角度来看,降低$c\rm (Co^{3+})$或 均能促进$\rm Co^{2+}$失电子,提高其还原性。
提高$c\\rm (Co^{2+})$
"]]从平衡移动的角度来看,降低生成物$c\rm (Co^{3+})$或提高反应物$c\rm (Co^{2+})$,均能促进$\rm Co^{2+}$失电子,提高其还原性。
[实验]①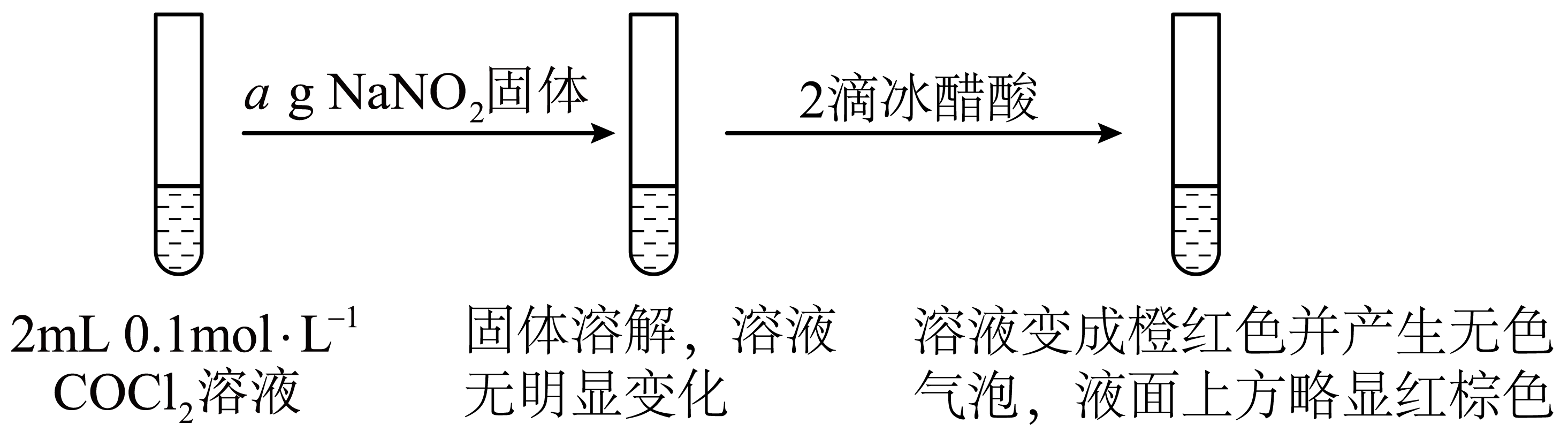
②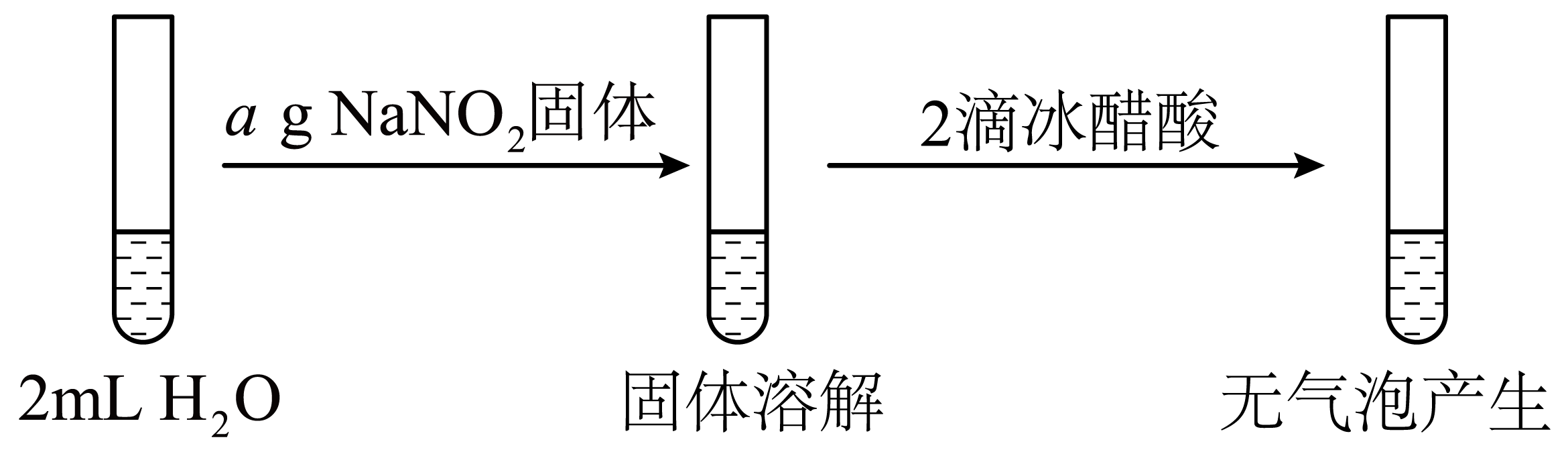
已知:ⅰ。${{{K}}_{\text{a}}}\left( \text{HN}{{\text{O}}_{2}} \right)={{10}^{-3.1}}$,${{ {K}}_{\text{a}}}\left( \text{C}{{\text{H}}_{3}}\text{COOH} \right)={{10}^{-4.8}}$;
ⅱ。$\rm HNO_{2}$不稳定,易分解:$3\text{HN}{{\text{O}}_{2}}=2\text{NO}\uparrow +\text{HN}{{\text{O}}_{3}}+{{\text{H}}_{2}}\text{O}$
②是①的对照实验,目的是 。
证明该条件下$\\text{NO}_{2}^{-}$遇$\\rm CH_{3}COOH$不会产生气泡
"]]实验①中,产生的现象是否为$\rm Co^{2+}$发生的转化,是否为$\rm NaNO_{2}$在酸性环境中发生的转化,需要进行实验证实,所以实验②是①的对照实验,目的是:证明该条件下$\text{NO}_{2}^{-}$遇$\rm CH_{3}COOH$不会产生气泡。
经检验,橙红色溶液中存在${{\left[ \text{Co}{{\left( \text{N}{{\text{O}}_{2}} \right)}_{6}} \right]}^{3-}}$。经分析,①中能实现$\overset{+2}{\mathop{\text{Co}}}\,\to \overset{+3}{\mathop{\text{Co}}}\,$的原因是$\rm Co^{3+}$形成配离子,且$\text{NO}_{2}^{-}$的氧化性被提高。
$\rm a$.解释$\rm Co^{3+}$能与$\rm \text{NO}_{2}^{-}$形成配位键的原因: 。
$\rm b$.结合还原半反应解释$\text{NO}_{2}^{-}$的氧化性被提高的原因: 。
$\\rm Co^{3+}$能够提供空轨道,$\\text{NO}_{2}^{-}$能够提供孤电子对 还原半反应为$\\rm 2H^{+}+\\text{NO}_{2}^{-}\\rm +e^{-}=NO+H_{2}O$,$\\rm CH_{3}COOH$电离出$\\rm H^{+}$,使$c\\rm (H^{+})$增大,促进$\\text{NO}_{2}^{-}$得电子
"]]$\rm a$.形成配位键时,中心原子提供空轨道,配位体提供孤电子对,则$\rm Co^{3+}$能与$\rm \text{NO}_{2}^{-}$形成配位键的原因:$\rm Co^{3+}$能够提供空轨道,$\rm \text{NO}_{2}^{-}$能够提供孤电子对。
$\rm b$.加入$\rm NaNO_{2}$时,反应并未发生,加入冰醋酸后,还原半反应发生,则醋酸提供的酸性环境提高了$\text{NO}_{2}^{-}$的氧化能力。从而得出$\text{NO}_{2}^{-}$的氧化性被提高的原因:还原半反应为$\rm 2H^{+}+\text{NO}_{2}^{-}\rm +e^{-}=NO+H_{2}O$,$\rm CH_{3}COOH$电离出$\rm H^{+}$,使$c\rm (H^{+})$增大,促进$\text{NO}_{2}^{-}$得电子。
[实验Ⅱ]
③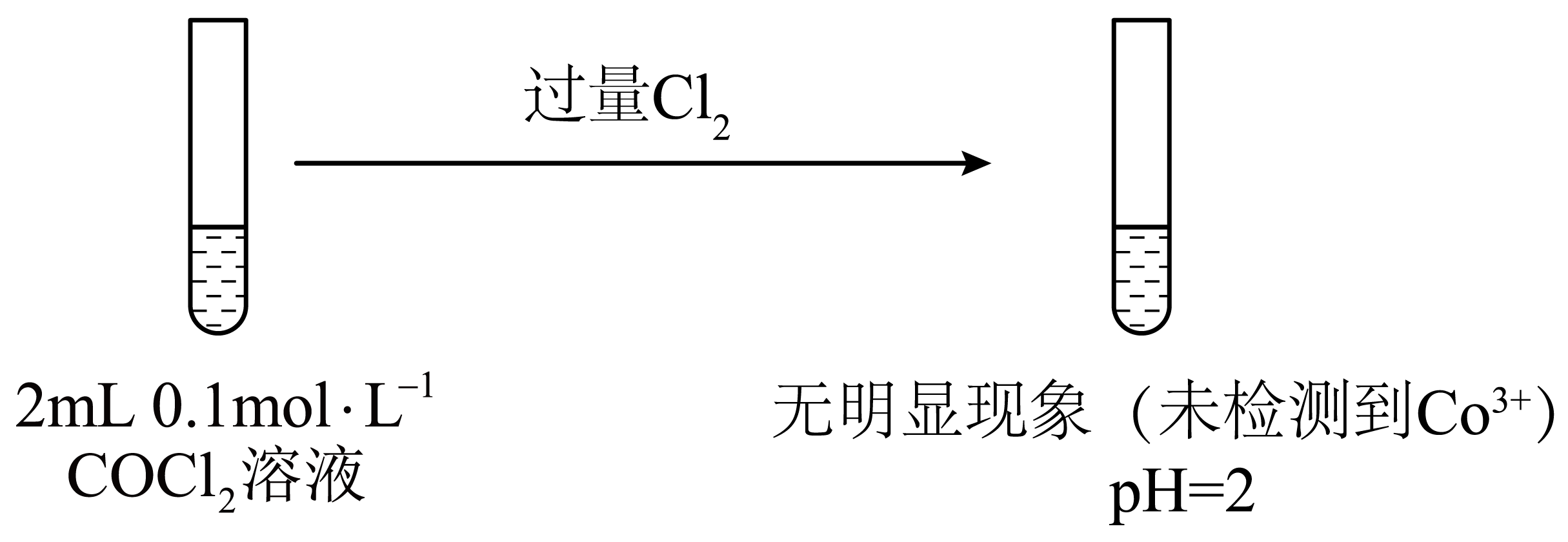
④
已知:$\rm Co(OH)_{2} ($粉红色$\rm )$和$\rm Co(OH)_{3} ($棕黑色$\rm )$的$ K_{\rm sp}$分别是$\rm 10^{-14.2}$和$\rm 10^{-43.8}$。
对比③④可知,本实验条件下还原性:$\rm Co(OH)_{2}$ $\rm Co^{2+} ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
$\\rm \\gt $
"]]实验③中,过量$\rm Cl_{2}$都不能将$\rm Co^{2+}$氧化,实验④中,通入少量$\rm Cl_{2}$就能将$\rm Co(OH)_{2}$氧化,则表明本实验条件下还原性:$\rm Co(OH)_{2}\gt Co^{2+}$。
分析④中能实现$\overset{+2}{\mathop{\text{Co}}}\,\to \overset{+3}{\mathop{\text{Co}}}\,$的原因:
$\rm a$.该条件下,$\rm Co^{2+}$的还原性同时受“$c\rm (Co^{3+})$降低”和“$c\rm (Co^{2+})$降低”的影响,前者影响更 $\rm ($填“大”或“小”$\rm )$。
$\rm b$.当${c\rm (Co^{2+})}:c\rm (Co^{3+})\gt 10^{14}$时,$\rm Co^{2+}$能被$\rm Cl_{2}$氧化。结合$ K_\rm {sp}$计算,④中通入少量$\rm Cl_{2}$后溶液${c\rm (Co^{2+})}:c\rm (Co^{3+})=$ ,因此能实现转化。
大;$\\rm 10^{27.6}$
"]]$\rm a$.该条件下,$\rm Co^{2+}$的还原性同时受“$c\rm (Co^{3+})$降低”和“$c\rm (Co^{2+})$降低”的影响,因为实现了$\overset{+2}{\mathop{\text{Co}}}\,\to \overset{+3}{\mathop{\text{Co}}}\,$,所以表明前者影响更大。
$\rm b$.④中通入少量$\rm Cl_{2}$后,部分粉红色的$\rm Co(OH)_{2}$立即变成棕色的$\rm Co(OH)_{3}$,继续通入$\rm Cl_{2}$后,全部变为棕黑色的$\rm Co(OH)_{3}$。在$\rm Co(OH)_{2}$、$\rm Co(OH)_{3}$共存的溶液中,有$\dfrac{c(\text{C}{{\text{o}}^{2+}})\cdot {{c}^{2}}(\text{O}{{\text{H}}^{-}})}{c(\text{C}{{\text{o}}^{3+}})\cdot {{c}^{3}}(\text{O}{{\text{H}}^{-}})}=\dfrac{{{K}_{\text{sp}}}[\text{Co(OH}{{\text{)}}_{2}}]}{{{K}_{\text{sp}}}[\text{Co(OH}{{\text{)}}_{3}}]}=\dfrac{{{10}^{-14.2}}}{{{10}^{-43.8}}}\rm =10^{29.6}$,则${c\rm (Co^{2+})}:c\rm (Co^{3+})=10^{29.6}\times c(OH^{-})=10^{29.6}\times 10^{-2}=10^{27.6}\gt 10^{14}$时,因此能实现转化。
实验启示:通常情况下,为促进低价金属阳离子向高价转化,可将高价阳离子转化为 或 。
更稳定的配合物;更难溶的沉淀
"]]实验启示:通常情况下,为促进低价金属阳离子向高价转化,需设法降低高价阳离子的浓度,可将高价阳离子转化为更稳定的配合物或更难溶的沉淀。
| 配合物理论题目答案及解析(完整版)
