高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
磷酸亚铁锂$\rm (\text{LiFeP}{{\text{O}}_{4}}\rm )$可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用$\text{FeC}{{\text{l}}_{3}}$、$\text{N}{{\text{H}}_{4}}{{\text{H}}_{2}}\text{P}{{\text{O}}_{4}}$、$\text{LiCl}$和苯胺等作为原料制备。回答下列问题:
在周期表中,与$\text{Li}$的化学性质最相似的邻族元素是 ,该元素基态原子核外$\rm M$层电子的自旋状态 $\rm ($填“相同”或“相反”$\rm )$。
镁;相反
"]]依据对角线规则,与$\rm Li$的化学性质最相似的邻族元素是镁,镁的$\rm M$层电子排布式为$\rm 3s^{2}$,电子的自旋状态相反。
苯胺$\rm ($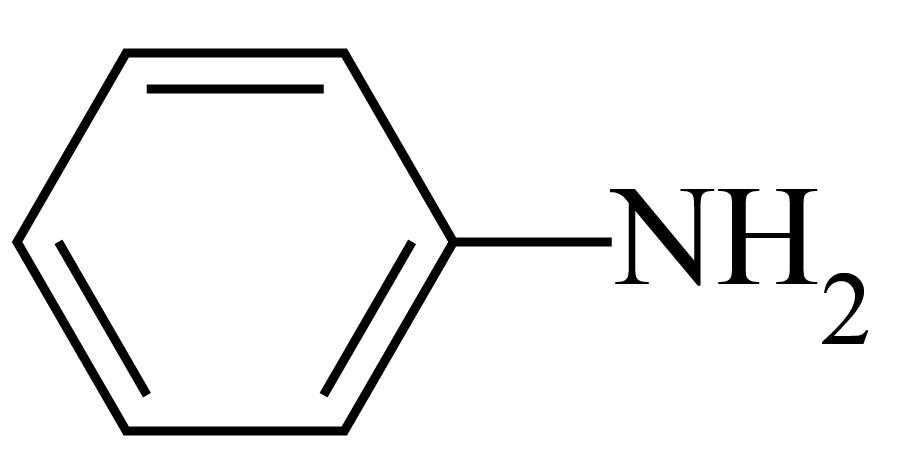 $\rm )$含有的官能团的名称是 ,其晶体类型是 。苯胺与甲苯$\rm ($
$\rm )$含有的官能团的名称是 ,其晶体类型是 。苯胺与甲苯$\rm ($![]() $\rm )$的相对分子质量相近,但苯胺的熔点$\rm (-5.9{}\;^\circ \text{C}\rm )$、沸点$\rm (184.4{}\;^\circ \text{C}\rm )$分别高于甲苯的熔点$\rm (-95.0{}\;^\circ \text{C}\rm )$、沸点$\rm (110.6{}\;^\circ \text{C}\rm )$,原因是 。
$\rm )$的相对分子质量相近,但苯胺的熔点$\rm (-5.9{}\;^\circ \text{C}\rm )$、沸点$\rm (184.4{}\;^\circ \text{C}\rm )$分别高于甲苯的熔点$\rm (-95.0{}\;^\circ \text{C}\rm )$、沸点$\rm (110.6{}\;^\circ \text{C}\rm )$,原因是 。
氨基;分子晶体;苯胺中存在电负性较强的$\\rm N$所以可以形成分子间氢键,因此比甲苯的熔、沸点高
"]]苯胺$\rm ($ $\rm )$含有的官能团的名称是氨基,其晶体类型是分子晶体。苯胺比甲苯的熔、沸点都高,同一种晶体类型熔、沸点不同首先要考虑的就是是否有氢键,苯胺中存在电负性较强的$\rm N$所以可以形成分子间氢键,因此比甲苯的熔、沸点高。
$\rm )$含有的官能团的名称是氨基,其晶体类型是分子晶体。苯胺比甲苯的熔、沸点都高,同一种晶体类型熔、沸点不同首先要考虑的就是是否有氢键,苯胺中存在电负性较强的$\rm N$所以可以形成分子间氢键,因此比甲苯的熔、沸点高。
基态$\text{F}{{\text{e}}^{2+}}$与$\text{F}{{\text{e}}^{3+}}$离子中未成对的电子数之比为 。
$\\rm 4:5$
"]]铁元素的原子序数为$\rm 26$,基态亚铁离子和铁离子的价电子排布式为$\rm 3d^{6}$、$\rm 3d^{5}$,电子排布图为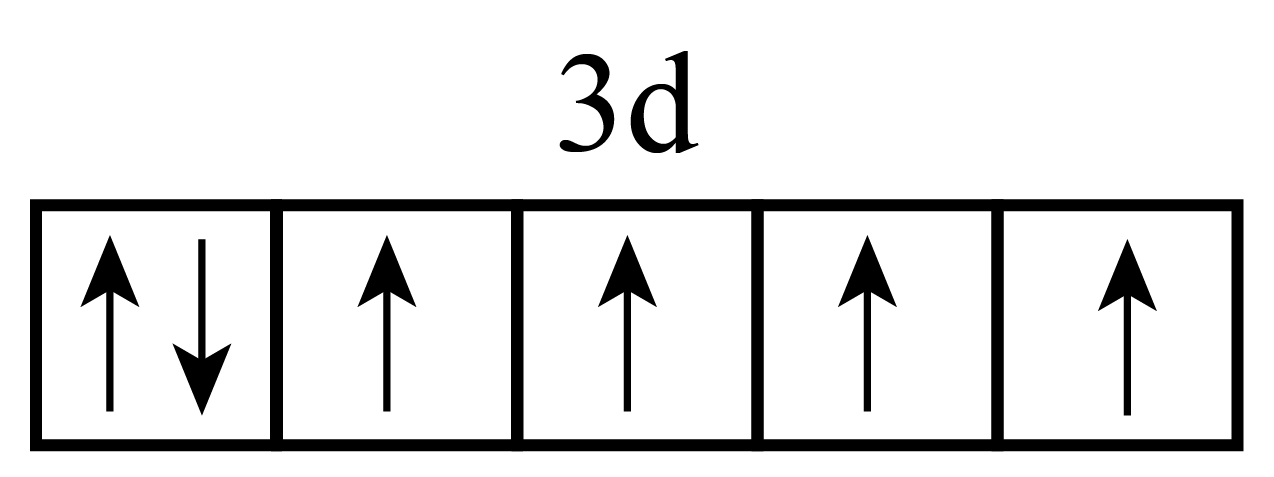 、
、![]() ,则离子中未成对的电子数之比为$\rm 4: 5$;
,则离子中未成对的电子数之比为$\rm 4: 5$;
在磷酸根离子$\rm (\text{P}{{\text{O}}_{4}}^{3-}\rm )$中,中心原子的价层电子对数为 。
$\\rm 4$
"]]在磷酸根离子$\left( \text{PO}_{4}^{3-} \right)$中,$\rm P$的价层电子对数为$\dfrac{5+3}{2}=4$。
比较$\text{L}{{\text{i}}^{+}}$与${{\text{H}}^{-}}$的半径大小关系:$ {r}\left( \text{L}{{\text{i}}^{+}} \right)$ $ r\left( {{\text{H}}^{-}} \right)\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
$\\rm \\lt $
"]]电子层数相同,质子数越多,离子半径越小,比较$\text{L}{{\text{i}}^{+}}$与${{\text{H}}^{-}}$的半径大小关系:$r\left( \text{L}{{\text{i}}^{+}} \right) \lt r\left( {{\text{H}}^{-}} \right)$;
$\text{LiFeP}{{\text{O}}_{4}}$的晶胞结构示意图如$\rm (a)$所示。其中$\mathrm{O}$围绕$\text{Fe}$和$\text{P}$分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有$\text{LiFeP}{{\text{O}}_{4}}$的单元数有 个。
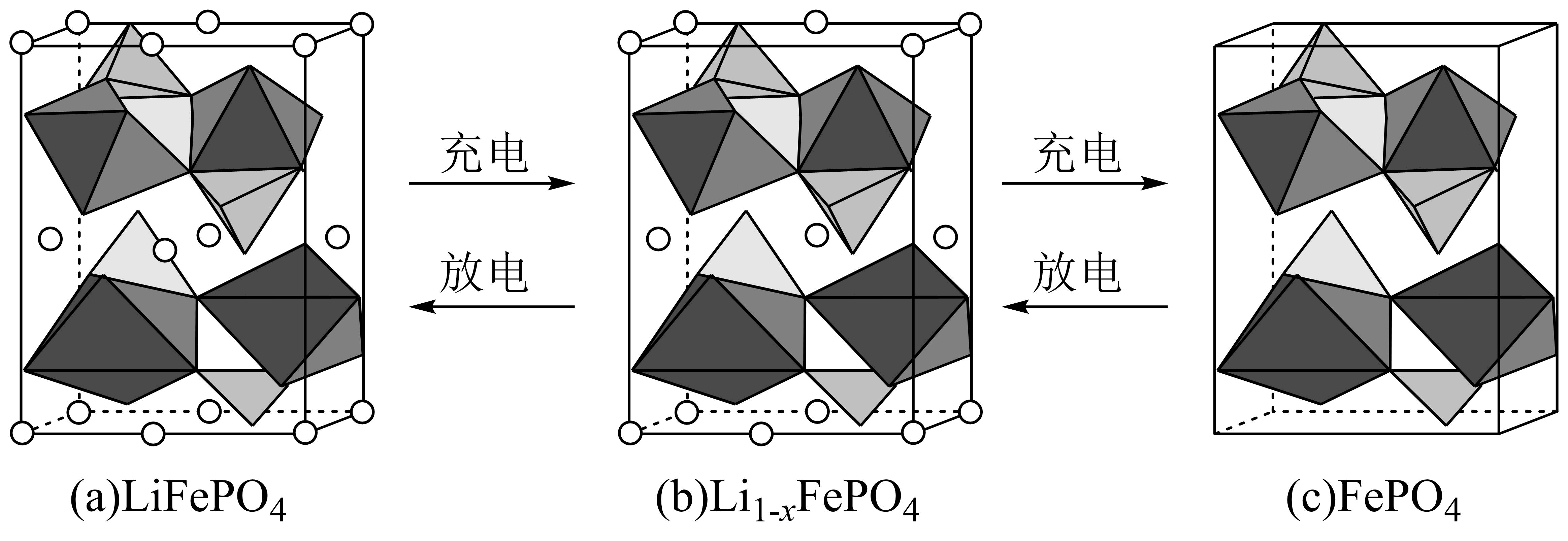
电池充电时,$\text{LiFeP}{{\text{O}}_{4}}$脱出部分$\text{L}{{\text{i}}^{+}}$,形成$\text{L}{{\text{i}}_{1-x}}\text{FeP}{{\text{O}}_{4}}$,结构示意图如$\rm (b)$所示,则$ {x}=$ ,$ {n}\left( \text{F}{{\text{e}}^{2+}} \right): {n}\left( \text{F}{{\text{e}}^{3+}} \right)=$ 。
$\\rm 4$;$\\dfrac{\\text{3}}{\\text{16}}$;$\\rm 13: 3$
"]]由晶胞结构可知,晶胞中位于顶点、面心和棱上的锂离子个数为$\rm 8\times \dfrac{1}{8}\rm +4\times \dfrac{1}{2}\rm +4\times \dfrac{1}{4}\rm =4$,则每个晶胞中含有$\rm 4$个$\rm LiFePO_{4}$;与图$\rm a$相比,图$\rm b$中晶胞缺失$\rm 1$个面心锂离子和$\rm 1$个棱上锂离子,晶胞中锂离子个数为$\rm 8\times \dfrac{1}{8}\rm +3\times \dfrac{1}{2}\rm +3\times \dfrac{1}{4}\rm =\dfrac{13}{4}$,则由晶胞化学式可得:$\dfrac{13}{4}:4=(1-x):1$,解得$ x=\dfrac{\text{3}}{\text{16}}$,设${\rm Li}_{1-x}\rm FePO_{4}$中亚铁离子为$a$个,由化合价代数和为$\rm 0$可得:$\dfrac{\text{3}}{\text{16}} +2a+3(1-a)+5-8=0$,解得$ a=\dfrac{13}{16}$,则化合物中亚铁离子和铁离子的物质的量比为$\dfrac{13}{16}:\dfrac{3}{16}\rm =13:3$。
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
