高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
$\rm I$.非金属氟化物在生产、生活和科研中应用广泛。
基态$\rm F$原子核外电子的空间运动状态有 种。
$\\rm 5$
"]]$\rm F$原子核外有$\rm 9$个电子,故基态$\rm F$原子核外的运动状态有$\rm 9$种
$\rm O$、$\rm F$、$\rm Cl$电负性由大到小的顺序为 ;$\rm OF_{2}$的熔、沸点 $\rm ($填“高于”或“低于”$\rm )Cl_{2}O$,原因是 。
$\\rm F\\gt O\\gt Cl$ ; 低于 ; $\\rm OF_{2}$和$\\rm Cl_{2}O$都是分子晶体,结构相似,$\\rm Cl_{2}O$的相对分子质量大,$\\rm Cl_{2}O$的熔、沸点高
"]]$\rm O$和$\rm F$同周期,且电负性$\rm F\gt O$,$\rm F$和$\rm Cl$同族,电负性:$\rm F\gt Cl$,在$\rm Cl_{2}O$分子中,氧为$\rm -2$价,所以电负性:$\rm O\gt Cl$,因此电负性:$\rm F\gt O\gt Cl$;$\rm OF_{2}$中心原子的价层电子对为$\rm 4$,孤电子对为$\rm 2$,故$\rm OF_{2}$的空间构型为$\rm V$型;$\rm OF_{2}$和$\rm Cl_{2}O$均为分子晶体,$\rm Cl2O$的相对分子质量较大,所以$\rm Cl_{2}O$分子间的作用力较大,熔点较高;
Ⅱ、过渡金属元素铬$\rm (Cr)$是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
对于基态$\rm Cr$原子,下列叙述正确的是 $\rm ($填标号$\rm )$。
$\rm A$.轨道处于半充满时体系总能量低,核外电子排布应为$\rm [Ar]3d^{4}4s^{2}$
$\rm B$.从空间角度看,$\rm 4s$轨道比$\rm 3s$轨道大,其空间包含了$\rm 3s$轨道
$\rm C$.电负性比钾高,原子对键合电子的吸引力比钾大
$\\rm BC$
"]]$\rm A$.基态原子满足能量最低原理,$\rm Cr$有$\rm 24$个核外电子,轨道处于半充满时体系总能量低,核外电子排布应为$\rm [Ar]3d^{5}4s^{2}$,$\rm A$错误; $\rm B$.从空间角度看,$\rm 4s$轨道比$\rm 3s$轨道大,其空间包含了$\rm 3s$轨道,$\rm B$正确; $\rm C$.电负性为原子对键合电子的吸引力,同周期除零族原子序数越大电负性越强,钾与铬位于同周期,铬原子序数大于钾,故铬电负性比钾高,原子对键合电子的吸引力比钾大,$\rm C$正确;
三价铬离子能形成多种配位化合物。${{\left[ \text{Cr}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{3}}\left( {{\text{H}}_{2}}\text{O} \right)\text{Cl} \right]}^{2+}}$中提供孤电子对形成配位键的原子是 ,中心离子的配位数为 。
$\\rm N$、$\\rm O$、$\\rm Cl$ ; $\\rm 6$
"]]${{\left[ \text{Cr}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{3}}\left( {{\text{H}}_{2}}\text{O} \right)\text{Cl} \right]}^{2+}}$中三价铬离子提供空轨道,$\rm N$、$\rm O$、$\rm Cl$提供孤对电子与三价铬离子形成配位键,中心离子的配位数为$\rm N$、$\rm O$、$\rm Cl$三种原子的个数和即$\rm 3+2+1=6$;
${{\left[ \text{Cr}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{3}}\left( {{\text{H}}_{2}}\text{O} \right)\text{Cl} \right]}^{2+}}$中配体分子$\rm NH_{3}$、$\rm H_{2}O$
①键角:$\rm NH_{3}$ $\rm H_{2}O($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
②$\rm NH_{3}$极易溶于水,原因是 。
$\\rm \\gt $ ; $\\rm NH_{3}$能与水反应,与水分子间形成氢键,且均为极性分子,相似相溶;
"]]①$\rm NH_{3}$含有一对孤对电子,而$\rm H_{2}O$含有两对孤对电子,$\rm H_{2}O$中的孤对电子对成键电子对的排斥作用较大;②$\rm NH_{3}$存在分子间氢键;
在金属材料中添加$\rm AlCr_{2}$颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。$\rm AlCr_{2}$具有体心四方结构,如图所示,处于顶角位置的是 原子。设$\rm Cr$和$\rm Al$原子半径分别为${{r}_{\text{Cr}}}\,\text{pm}$和${{r}_{\text{Al}}}\,\text{pm}$,晶胞参数如图所示,已知:空间占有率$\rm =$晶胞中原子总体积$\rm /$晶胞体积,则金属原子空间占有率为 $\rm \%($列出计算表达式$\rm )$。
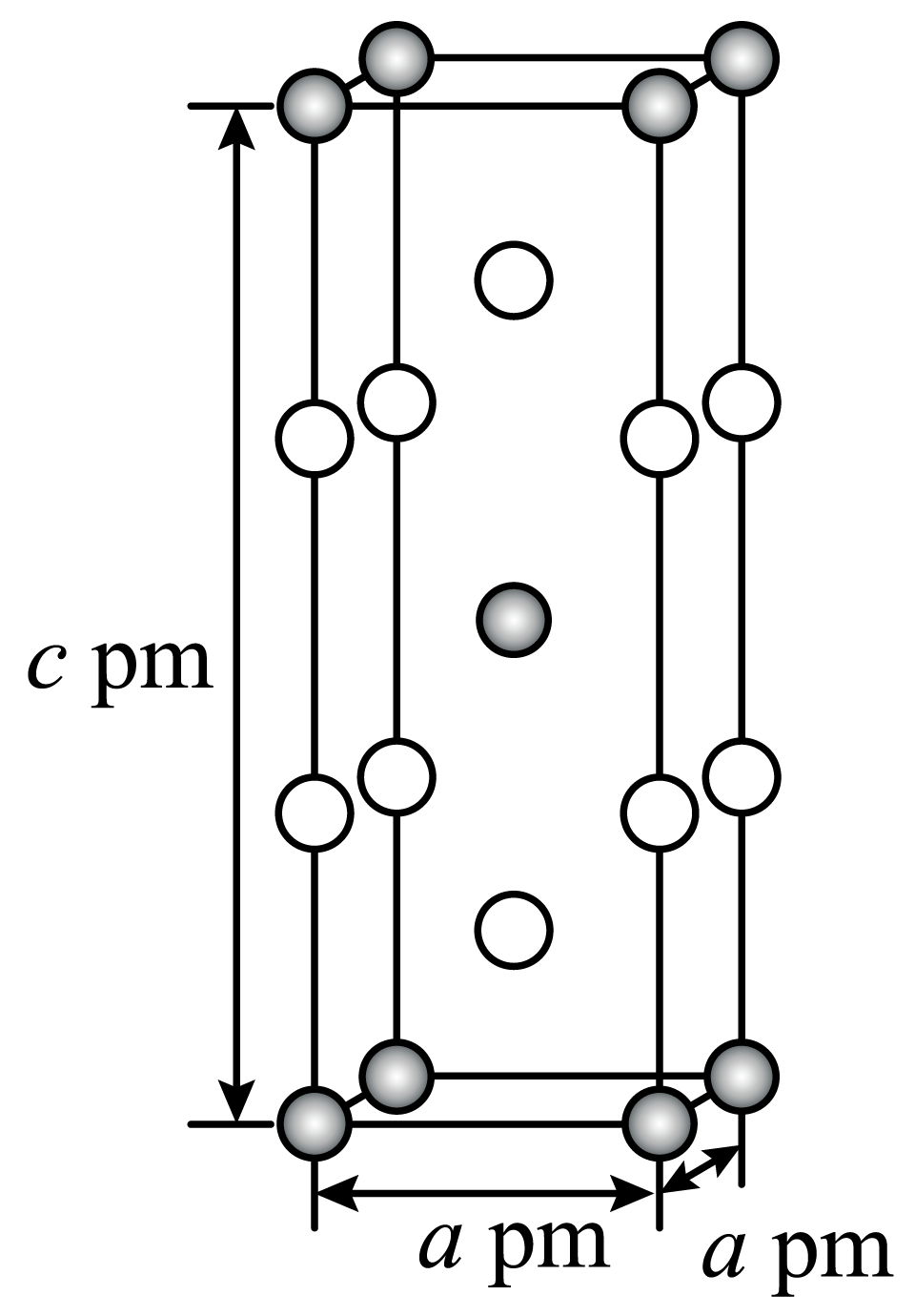
$\\rm Al$ ; $\\dfrac{8\\pi \\left( 2r_{\\text{C}r}^{3}+r_{\\text{Al}}^{\\text{3}} \\right)}{3{{a}^{2}}c}\\times 100$
"]]已知$\rm AlCr_{2}$具有体心四方结构,如图所示,黑球个数为$8\times \dfrac{1}{8}+1=2$,白球个数为$8\times \dfrac{1}{4}+2=4$,结合化学式$\rm AlCr_{2}$可知,白球为$\rm Cr$,黑球为$\rm Al$,即处于顶角位置的是$\rm Al$原子。设$\rm Cr$和$\rm Al$原子半径分别为${{r}_{\text{Cr}}}$和${{r}_{\text{Al}}}$,则金属原子的体积为$\dfrac{4\pi {{r}^{\text{3}}}_{\text{Cr}}}{3}\times 4+\dfrac{4\pi {{r}^{3}}_{\text{Al}}}{3}\times 2=\dfrac{8\pi ({{r}^{\text{3}}}_{\text{Cr}}+{{r}^{\text{3}}}_{\text{Al}})}{3}$,故金属原子空间占有率$=\dfrac{\dfrac{8\pi ({{r}^{3}}_{\text{Cr}}+{{r}^{3}}_{\text{Al}})}{3}}{{{a}^{2}}c}\times 100\%=\dfrac{8\pi ({{r}^{3}}_{\text{Cr}}+{{r}^{3}}_{\text{Al}})}{3{{a}^{2}}c}\times 100\%\rm \%$;
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
