高中 | 偏铝酸盐的化学性质 题目答案及解析
稿件来源:高途
高中 | 偏铝酸盐的化学性质题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
偏铝酸盐的化学性质
某铬铁(Ⅱ)矿主要成分为$\text{Fe}{{\left( \text{Cr}{{\text{O}}_{2}} \right)}_{2}}$,还含有$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}\text{MgO}\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$等杂质,采用次氯酸钠法处理矿石并制备$\text{Cr}{{\text{O}}_{3}}$的工艺流程如图。已知“氧化浸出”时铁以最高价氧化物的形式存在。
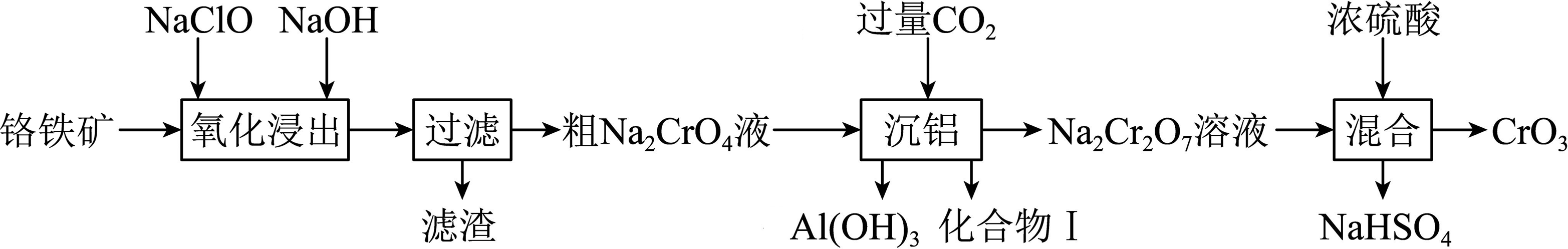
铁元素在周期表中的位置是 。
第四周期第Ⅷ族
"]]铁在元素周期表中位于第四周期第Ⅷ族;
“氧化浸出”时,为了加快反应速率,可采取的措施有 (答两条)。
增大$\\text{NaClO}$浓度、搅拌、升温、粉碎铬铁矿
"]]“氧化浸出”时,为了加快反应速率,可采取的措施有增大$\rm NaClO$浓度(增大反应物浓度,加快反应速率)、搅拌(增大接触面积,加快反应速率)、升温(升高温度、加快反应速率)、粉碎铬铁矿(增大接触面积,加快反应速率);
“氧化浸出”时,$\text{Fe}{{\left( \text{Cr}{{\text{O}}_{2}} \right)}_{2}}$发生的化学方程式为 。
$\\text{2Fe}{{\\left( \\text{Cr}{{\\text{O}}_{\\text{2}}} \\right)}_{2}}+\\text{7NaClO}+\\text{8NaOH}=\\text{F}{{\\text{e}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}+\\text{4N}{{\\text{a}}_{\\text{2}}}\\text{Cr}{{\\text{O}}_{\\text{4}}}+\\text{7NaCl}+\\text{4}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]$\rm Fe(CrO_{2})_{2}$中$\rm Fe$、$\rm Cr$的化合价依次为$\rm +2$、$\rm +3$价,“氧化浸出”时$\rm Fe$以最高价氧化物的形式存在,则$\rm Fe(CrO_{2})_{2}$被$\rm NaClO$氧化成$\rm Fe_{2}O_{3}$、$\rm Na_{2}CrO_{4}$,$\rm NaClO$被还原成$\rm NaCl$,根据得失电子守恒、原子守恒,反应的化学方程式为$\rm 2Fe(CrO_{2})_{2}+7NaClO+8NaOH=Fe_{2}O_{3}+4Na_{2}CrO_{4}+7NaCl+4H_{2}O$;
滤渣的主要成分是 。
$\\text{MgO}$、$\\text{F}{{\\text{e}}_{2}}{{\\text{O}}_{3}}$
"]]根据分析,滤渣的主要成分为$\rm MgO$、$\rm Fe_{2}O_{3}$;
“沉铝”时,铝元素发生的离子方程式为 。
${{\\left[ \\text{Al(OH}{{\\text{)}}_{\\text{4}}} \\right]}^{-}}\\text{+C}{{\\text{O}}_{\\text{2}}}\\text{=Al(OH}{{\\text{)}}_{\\text{3}}}\\downarrow \\text{+HCO}_{\\text{3}}^{-}$
"]]“沉铝”时,$\rm [Al(OH)_{4}]^{-}$转化成$\rm Al(OH)_{3}$沉淀,反应的离子方程式为$\rm [Al(OH)_{4}]^{-}+CO_{2}=Al(OH)_{3}↓+\text{HCO}_{\text{3}}^{-}$;
“混合”时,如何进行具体的实验操作?$(\quad\ \ \ \ )$(填字母)。
将浓硫酸沿器壁慢慢倒入$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{r}}_{2}}{{\\text{O}}_{7}}$溶液中,边加边搅拌
","将$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{r}}_{2}}{{\\text{O}}_{7}}$溶液沿器壁慢慢倒入浓硫酸中,边加边搅拌
","将$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{r}}_{2}}{{\\text{O}}_{7}}$溶液和浓硫酸同时倒入容器中,搅拌均匀
"]浓硫酸的密度大,且浓硫酸溶于水放出大量的热,故“混合”时将浓硫酸沿器壁慢慢倒入$\rm Na_{2}Cr_{2}O_{7}$溶液中,边加边搅拌,选$\rm A$;
该工艺的某一副产物还可以用来制备硫酸亚铁晶体。硫酸亚铁晶体的溶解度如表所示,由硫酸亚铁溶液制备绿矾$\left( \text{FeS}{{\text{O}}_{4}}\cdot 7{{\text{H}}_{2}}\text{O} \right)$的“操作”包括真空加热浓缩、 、过滤、洗涤、干燥。
| 温度$\rm /^\circ\rm C$ | $\rm 0$ | $\rm 10$ | $\rm 30$ | $\rm 50$ | $\rm 56.7$ | $\rm 60$ | $\rm 64$ | $\rm 70$ | $\rm 80$ | $\rm 90$ |
| 溶解度$\rm /g$ | $\rm 14.0$ | $\rm 17.0$ | $\rm 25.0$ | $\rm 33.0$ | $\rm 35.2$ | $\rm 35.3$ | $\rm 35.6$ | $\rm 33.0$ | $\rm 30.5$ | $\rm 27$ |
| 析出晶体 | $\text{FeS}{{\text{O}}_{4}}\cdot 7{{\text{H}}_{2}}\text{O}$ | $\text{FeS}{{\text{O}}_{4}}\cdot 4{{\text{H}}_{2}}\text{O}$ | $\text{FeS}{{\text{O}}_{4}}\cdot {{\text{H}}_{2}}\text{O}$ | |||||||
低于$50\\;^\\circ \\rm C $冷却结晶
"]]由表中数据知,温度低于$\rm 50\;\rm ^\circ\rm C$时才会析出$\rm FeSO_{4}\cdot 7H_{2}O$,故由硫酸亚铁溶液制备绿矾($\rm FeSO_{4}\cdot 7H_{2}O$)的“操作”包括真空加热浓缩、低于$50\;^\circ \rm C $冷却结晶、过滤、洗涤、干燥。
高中 | 偏铝酸盐的化学性质题目答案及解析(完整版)
