高中 | 偏铝酸盐的化学性质 题目答案及解析
稿件来源:高途
高中 | 偏铝酸盐的化学性质题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
偏铝酸盐的化学性质
如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
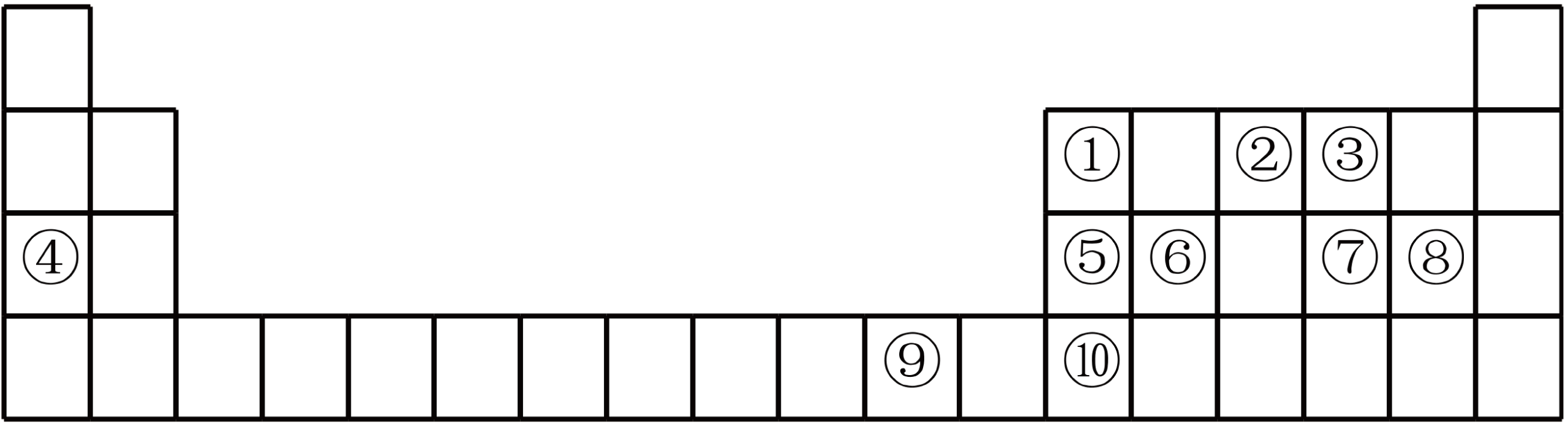
⑨号元素基态原子价电子排布式为 ,其最高能层的电子占据的原子轨道电子云轮廓为 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液, 写出该溶液溶质的化学式 。
$\\rm 3d^{10}4s^{1}$;球形;$\\rm [Cu (NH_{3})_{4}](OH)_{2}$
"]]⑨是$\rm 29$号$\rm Cu$元素,其基态原子核外电子排布式为$\rm [Ne] 3d^{10}4s^{1}$,所以其价电子排布式为$\rm 3d^{10}4s^{1}$;其最高能层的电子占据的原子轨道为$\rm s$轨道,故电子云轮廓为球形;且最高价氧化物的水化物为$\rm Cu(OH)_{2}$,溶于氨水中得到一种透明的深蓝色溶液,溶质是$\rm [Cu (NH_{3})_{4}](OH)_{2}$。
第二周期所有元素中第一电离能介于①②之间的有 种。
$\\rm 3$
"]]①是$\rm B$元素,②是$\rm N$元素,第二周期所有元素中第一电离能介于①②之间的,根据同周期第一电离能的变化规律和Ⅱ$\rm A$和Ⅴ$\rm A$的特殊性,有$\rm Be$、$\rm C$、$\rm O$ 三种元素;
写出$\rm 1\;\rm mol$由元素③⑥组成的共价化合物中含有$\rm \sigma$键的个数 ,该化合物与氢氟酸反应的化学方程式为: 。
$4N\\rm _{A}$或$\\rm 2.408\\times 10\\rm ^{24}$;$\\rm 4HF+SiO_{2}=SiF_{4}↑+2H_{2}O$
"]]③是$\rm O$元素,⑥是$\rm Si$元素,元素③⑥组成的化合物为$\rm SiO_{2}$,根据$\rm SiO_{2}$的结构,$\rm 1$个$\rm Si$原子与周围四个氧原子形成$\rm 4$个共价键,根据均摊法,则$\rm 1\;\rm mol\;\rm SiO_{2}$中含有$\rm \sigma$键的个数为$4N\rm _{A}$或$\rm 2.408\times 10\rm ^{24}$;$\rm SiO_{2}$与氢氟酸反应的化学方程式为$\rm 4HF+SiO_{2}=SiF_{4}↑+2H_{2}O$。
请解释②的最常见氢化物易液化的原因。 。
氨气易液化的原因是因为氨气的分子中含有氢键,使分子间的相互作用力增大,熔沸点升高
"]]②是$\rm N$元素,其氢化物为氨气,氨气易液化的原因是因为氨气的分子中含有氢键,使分子间的相互作用力增大,熔沸点升高,所以氨气易液化。
向由③④⑤三种元素组成的化合物溶液中通入少量二氧化碳的离子方程式: 。
$\\text{2AlO}_{2}^{-}\\text{+C}{{\\text{O}}_{\\text{2}}}\\text{+3}{{\\text{H}}_{\\text{2}}}\\text{O=2Al}{{\\left( \\text{OH} \\right)}_{\\text{3}}}\\downarrow \\text{+CO}_{3}^{2-}$
"]]③是$\rm O$元素,④是$\rm Na$元素,⑤是$\rm Al$元素,三种元素组成的化合物溶液为偏铝酸钠溶液,其与少量二氧化碳反应的离子方程式是$\text{2AlO}_{2}^{-}\text{+C}{{\text{O}}_{\text{2}}}\text{+3}{{\text{H}}_{\text{2}}}\text{O=2Al}{{\left( \text{OH} \right)}_{\text{3}}}\downarrow \text{+CO}_{3}^{2-}$。
下列有关性质的比较正确且能用元素周期律解释的是$(\quad\ \ \ \ )\rm ($填标号$\rm )$。
最常见的氢化物的沸点:③$\\rm \\gt $⑦
","最常见气态氢化物的稳定性:③$\\rm \\gt $⑦
","最高价氧化物对应的水化物的碱性:④$\\rm \\gt $⑤
","电负性: ②$\\rm \\gt $③
"]$\rm A$.③是$\rm O$元素,⑦是$\rm S$元素,他们氢化物的沸点$\rm H_{2}O\gt H_{2}S$,是因为水分子间存在氢键,不能用元素周期律解释,故$\rm A$不符合题意;
$\rm B$.③是$\rm O$元素,⑦是$\rm S$元素,他们氢化物的稳定性$\rm H_{2}O\gt H_{2}S$,是因为氧的非金属性比硫强,能用元素周期律解释,故$\rm B$符合题意;
$\rm C$.④是$\rm Na$元素,⑤是$\rm Al$元素,他们最高价氧化物对应的水化物的碱性$\rm NaOH\gt Al (OH)_{3}$,是因为钠的金属性比铝强,能用元素周期律解释,故$\rm C$符合题意;
$\rm D$.②是$\rm N$元素,③是$\rm O$元素,电负性$\rm O\gt N$,即②$\rm \lt $③,而不是②$\rm \gt $③,则不能用元素周期律解释,故$\rm D$不符合题意;
答案$\rm BC$。
⑩可形成的卤化物的熔点如下表:
| 卤化物 | 氟化物 | 氯化物 | 溴化物 |
| 熔点$\rm /^\circ\rm C$ | $\rm \gt 1000$ | $\rm 77.75$ | $\rm 122.3$ |
⑩的氟化物的化学式为 ,该物质的熔点比氯化物熔点高很多的原因是 。
$\\rm GaF_{3}$;$\\rm GaF_{3}$是离子晶体,$\\rm GaCl_{3}$是分子晶体,离子键强于分子间作用力。
"]]⑩是$\rm Ga$元素,则其氟化物的化学式为$\rm GaF_{3}$,$\rm F$的电负性为$\rm 4.0$,$\rm Ga$的电负性为$\rm 1.6$,二者相差$\rm 2.4$,大于$\rm 1.7$,故$\rm GaF_{3}$是离子键构成的离子化合物。$\rm Cl$的电负性为$\rm 3.0$,其与$\rm Ga$的电负性差值为$\rm 1.4$,小于$\rm 1.7$,则$\rm GaCl_{3}$是共价键构成的共价化合物,是分子晶体,故$\rm GaF_{3}$比$\rm GaCl_{3}$的熔点高很多。
$\rm 0.1\;\rm mol$⑧的单质与焦炭、$\rm TiO_{2}$完全反应,生成一种还原性气体和一种易水解成${\rm TiO_{2}}·x\rm H_{2}O$的液态化合物,放热$\rm 4.28\;\rm kJ$,该反应的热化学方程式为 。
${\\rm TiO_{2}(s)+ 2C(s) +2Cl_{2}(g)= TiCl4(l)+2CO (g)}\\qquad\\Delta H=-85.6\\;\\rm \\text{kJ}\\cdot\\text{mo}{{\\text{l}}^{-1}}$
"]]⑧是$\rm Cl$元素,其单质$\rm Cl_{2}$与焦炭、$\rm TiO_{2}$完全反应,生成的具有还原性气体为$\rm CO$,易水解成${\rm TiO_{2}}·x\rm H_{2}O$的液态化合物为$\rm TiCl_{4}$,$\rm 0.1\; mol$的$\rm Cl_{2}$放热$\rm 4.28\;\rm kJ$,则$\rm 2\; mol\;Cl_{2}$参加反应放热$\rm 85.6\;\rm kJ$,故反应的热化学方程式是${\rm TiO_{2}(s)+ 2C(s) +2Cl_{2}(g)= TiCl4(l)+2CO (g)}\qquad\Delta H=-85.6\;\rm \text{kJ}\cdot\text{mo}{{\text{l}}^{-1}}$。
高中 | 偏铝酸盐的化学性质题目答案及解析(完整版)
