高中 | 偏铝酸盐的化学性质 题目答案及解析
稿件来源:高途
高中 | 偏铝酸盐的化学性质题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
偏铝酸盐的化学性质
铝是一种重要金属,从铝土矿$\rm ($主要成分为$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$,$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\text{Si}{{\text{O}}_{2}}$等$\rm )$中冶炼$\text{Al}$的工业生产流程如下图:$\rm (\text{Si}{{\text{O}}_{2}}$是酸性氧化物,不溶于盐酸$\rm )$
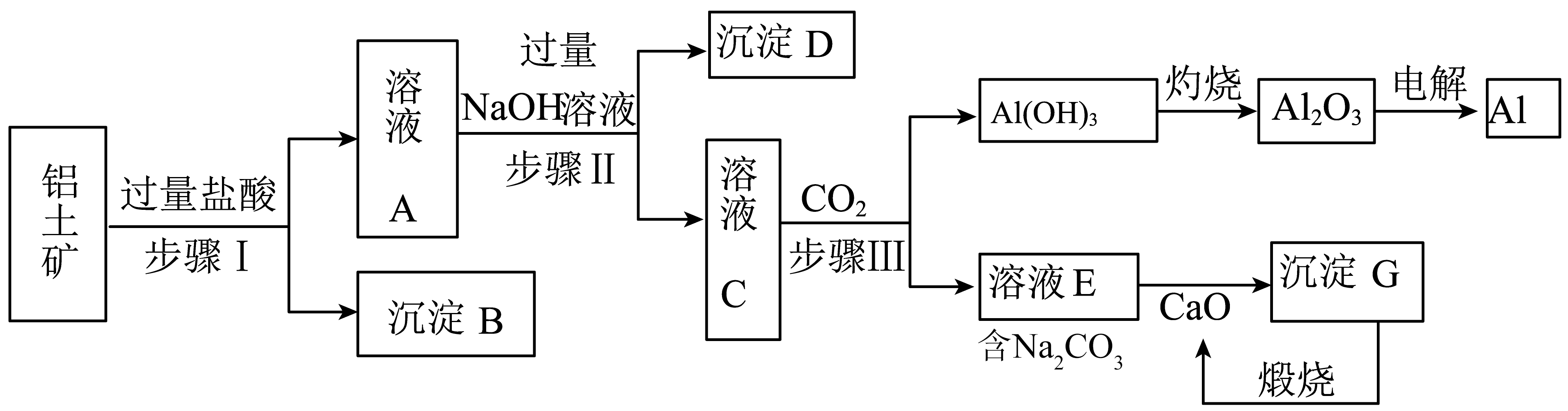
步骤$\rm I$中,为了提高铝土矿利用率可采取的措施有 $\rm ($任写一种$\rm )$;沉淀$\rm B$为 $\rm ($填化学式$\rm )$。
将铝土矿粉碎$\\rm /$适当升温 ; $\\text{Si}{{\\text{O}}_{\\text{2}}}$
"]]步骤Ⅰ中,为了提高铝土矿利用率可采取的措施:将铝土矿粉碎或适当升高温度;由上述分析可知固体$\rm B$为$\rm SiO_{2}$;
步骤Ⅰ、Ⅱ、Ⅲ都要用到的分离方法是 ,该方法要用到的玻璃仪器有除了烧杯,还有 。
过滤 ; 玻璃棒、漏斗
"]]据分析,步骤Ⅰ、Ⅱ、Ⅲ都要用到的分离方法是过滤,该操作要用到的玻璃仪器有:烧杯 、玻璃棒、漏斗。
步骤Ⅲ中向溶液$\rm C$中通入少量$\text{C}{{\text{O}}_{\text{2}}}$,生成 $\rm Al(OH)_{3}$沉淀的离子方程式 。
$2\\text{AlO}_{2}^{-}+\\text{C}{{\\text{O}}_{2}}+3{{\\text{H}}_{2}}\\text{O}=2\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +\\text{CO}_{3}^{2-}$
"]]向溶液$\rm C$中通入少量$\rm CO_{2}$生成 $\rm Al(OH)_{3}$沉淀,即偏铝酸钠和少量$\rm CO_{2}$反应生成 $\rm Al(OH)_{3}$沉淀和碳酸钠溶液,离子方程式$\rm 2AlO_{2}^{-}$ $\rm +$ $\rm CO_{2}$ $\rm +$ $\rm 3H_{2}O$ $\rm =$ $\rm 2Al(OH)_{3}↓$ $\rm +$ $\rm CO_{\text{3}}^{\text{2}-}$。
生产过程中,除$\text{CaO}$可以循环使用外,还可以循环使用的物质有$\text{C}{{\text{O}}_{\text{2}}}$、 $\rm ($填化学式$\rm )$。
$\\text{NaOH}$
"]]据分析,生产过程中,除$\rm CaO$可以循环使用外,还可以循环使用的物质有$\rm CO_{2}$、$\rm NaOH$。
经分析,$a$吨铝土矿可以冶炼出$b$吨的铝$\rm ($假设各生产环节中无损耗$\rm )$,则原铝土矿中$\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$的纯度$\rm ($质量分数$\rm )$ $\rm ($用含$a$、$b$的最简式表示$\rm )$。
$\\dfrac{17b}{9a}\\times 100\\%$
"]]经分析,$a$吨铝土矿可以冶炼出$b$吨的铝$\rm ($假设各生产环节中无损耗$\rm )$,则根据铝元素守恒可知,$\begin{matrix} \text{2Al} &\sim & \text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}} \\ 54 & {} & 102 \\ b {吨} && \dfrac{102b}{54}吨 \\ \end{matrix}\,\rm ..$,需要纯氧化铝的质量为$\dfrac{102b}{54}$ 吨,所以原铝土矿中$\rm Al_{2}O_{3}$的纯度为$\dfrac{102b}{54a}\times 100\% =\dfrac{17 b}{9 a}\rm \times 100\%$。
高中 | 偏铝酸盐的化学性质题目答案及解析(完整版)
