高中 | 氢氧化铝 题目答案及解析
稿件来源:高途
高中 | 氢氧化铝题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
氢氧化铝
离子反应是中学化学中重要的反应类型,现有无色溶液,可能含有以下离子中的若干种:${{\text{H}}^{+}}$、${{\text{K}}^{+}}$、$\text{A}{{\text{l}}^{3+}}$、$\text{F}{{\text{e}}^{3+}}$、$\text{M}{{\text{g}}^{2+}}$、$\text{NH}_{4}^{+}$、$\text{C}{{\text{l}}^{-}}$、$\text{CO}_{3}^{2-}$、$\text{SO}_{4}^{2-}$,现取三份$\rm 100$ $\rm mL$该混合溶液进行如下实验。$\rm ($已知:$\text{NH}_{4}^{+}+\text{O}{{\text{H}}^{-}}=\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}\rm )$
实验①:向第一份混合溶液中加入$\text{AgN}{{\text{O}}_{3}}$溶液,有沉淀产生;
实验②:向第二份混合溶液中滴加$\text{1}\text{.00}\,\text{mol}\cdot {{\text{L}}^{-1}}$的$\rm NaOH$溶液,溶液中沉淀的质量与氢氧化钠的体积关系如图所示:
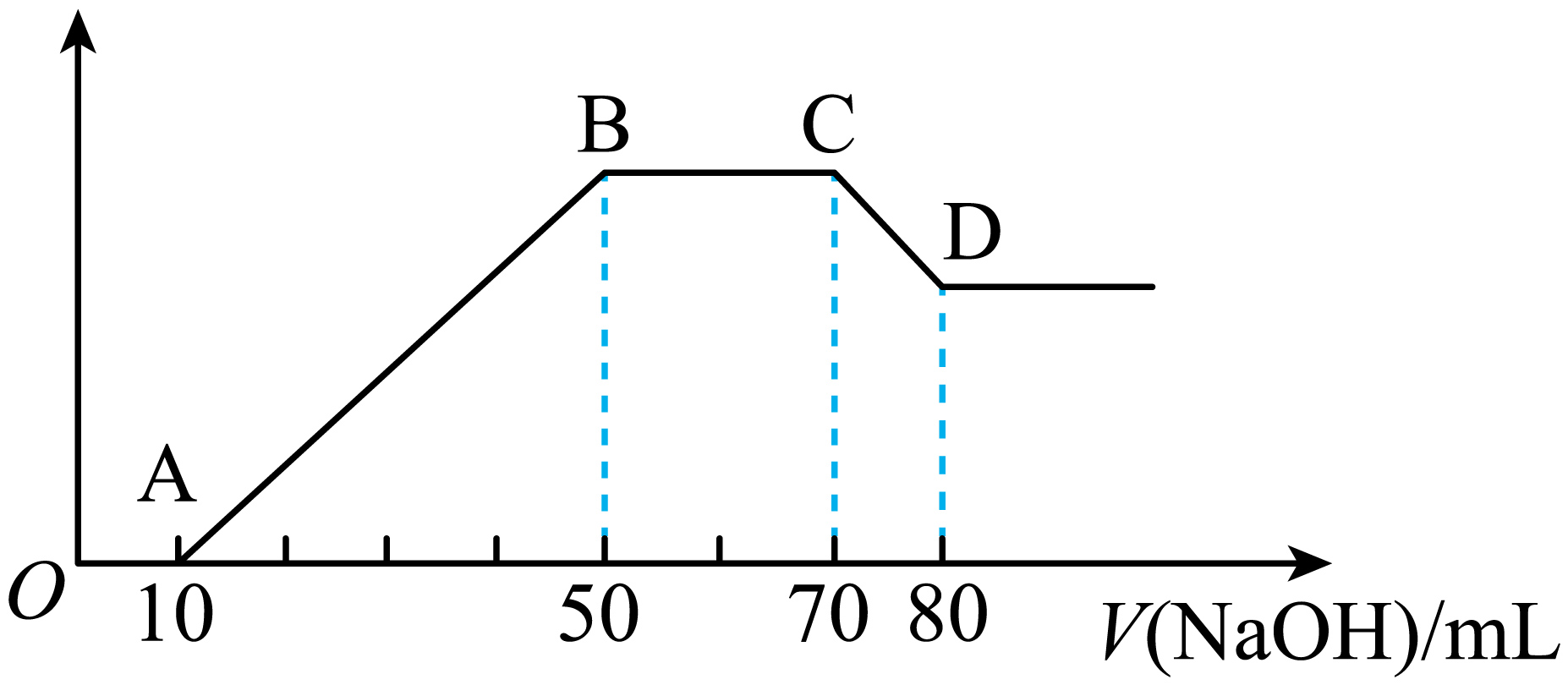
实验③:向第三份混合溶液中加入足量$\text{BaC}{{\text{l}}_{2}}$溶液后,得到干燥的沉淀$\rm 6.99$ $\rm g$。
由上述实验可以判断,溶液中一定不存在的离子为 。
$\\text{F}{{\\text{e}}^{3+}}$、$\\text{CO}_{\\text{3}}^{\\text{2-}}$
"]]无色溶液中不含$\rm Fe^{3+}$,向第二份混合溶液中滴加的$\rm 1.00$ $\rm mol·L^{-1}$ $\rm NaOH$溶液,$V\left( \text{NaOH} \right)$为$\rm 0$~$\rm 10$ $\rm ml$时没有沉淀生成,发生的离子反应为$\rm H^{+}+OH^{-}=H_{2}O$,说明含有$\rm H^{+}$,不含$\text{CO}_{3}^{2-}$;
实验②中沉淀质量减少的离子方程式 。
$\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}+\\text{O}{{\\text{H}}^{-}}=\\text{Al}\\left( \\text{OH} \\right)_{4}^{-}$
"]]实验②中沉淀质量减少发生$\rm Al(OH)_{3}$溶于$\rm NaOH$,反应的离子方程式:$\text{Al}{{\left( \text{OH} \right)}_{3}}+\text{O}{{\text{H}}^{-}}=\text{Al}\left( \text{OH} \right)_{4}^{-}$;
$\text{C}{{\text{l}}^{-}}$是否存在 $\rm ($“是”或“否”$\rm )$,若存在,则浓度为$\text{c}$ $\rm ($若答“否”,则此问无需作答$\rm )$。
是 ; $\\ge 0.1\\ \\text{mol}/\\text{L}$
"]]根据分析溶液中有$\rm Al^{3+}0.01$ $\rm mol$,$\rm Mg^{2+}0.005$ $\rm mol$,$\rm H^{+}0.01$ $\rm mol$,$\text{NH}_{4}^{+}0.02\,\text{mol}$, $\text{SO}_{4}^{2-}\rm 0.03$ $\rm mol$,根据电荷守恒溶液中含有$\rm Cl^{-}$,其物质的量至少为$\rm (0.01\times 3+0.005\times 2+0.01\times 1+0.02\times 1)$ $\rm mol-0.03\times 2$ $\rm mol=0.01$ $\rm mol$,若溶液中含有$\rm K^{+}$,$\rm Cl^{-}$物质的量要大于$\rm 0.01$ $\rm mol$,因此$\rm Cl^{-}$的浓度为${c}\ge \dfrac{0.01\,\text{mol}}{0.1\,\text{L}}=0.1\,\text{mol}/\text{L}$;
$\rm D$点溶液与下列溶液能大量共存的是 。
$\rm A$.${{\text{H}}^{+}}$、$\text{SO}_{\text{4}}^{\text{2-}}$、$\text{M}{{\text{g}}^{2+}}$
$\rm B$.$\text{F}{{\text{e}}^{3+}}$、$\text{NO}_{3}^{-}$、$\text{C}{{\text{l}}^{-}}$
$\rm C$.$\text{CO}_{\text{3}}^{\text{2-}}$、$\text{O}{{\text{H}}^{-}}$、$\text{N}{{\text{a}}^{+}}$
$\rm D$.$\text{HCO}_{3}^{-}、\text{A}{{\text{g}}^{+}}、\text{B}{{\text{r}}^{-}}$
$\\rm C$
"]]$\rm D$点时溶液中有$\rm Na^{+}$、$\rm NH_{3}·H_{2}O$、$\rm [Al(OH)_{4}]^{-}$、$\rm Cl^{-}$、$\text{SO}_{4}^{2-}$,$\rm A$中$\rm H^{+}$不能大量共存,$\rm B$中$\rm Fe^{3+}$会生成$\rm Fe(OH)_{3}$沉淀、不能大量共存,$\rm C$可以大量共存,$\rm D$中的$\rm Ag^{+}$与$\rm Cl^{-}$、$\rm Br^{-}$会沉淀、不能大量共存。
高中 | 氢氧化铝题目答案及解析(完整版)
