高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
在普通铝中加入少量$\text{Cu}$和$\text{Mg}$后,形成一种称为拉维斯相的$\text{MgC}{{\text{u}}_{2}}$微小晶粒,其分散在$\text{Al}$中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
下列状态的镁中,电离最外层一个电子所需能量最大的是 $\rm ($填标号$\rm )$。
$\rm A$.$\left[ \text{Ne} \right]3{{\text{s}}^{1}}$ $\rm B$.$\left[ \text{Ne} \right]3{{\text{s}}^{2}}$ $\rm C$.$\left[ \text{Ne} \right]3{{\text{s}}^{1}}3{{\text{p}}^{1}}$ $\rm D$.$\left[ \text{Ne} \right]3{{\text{p}}^{1}}$
$\\rm A$
"]]$\rm A$.图示电离最外层一个电子所需能量为$\rm Mg$的第二电离能;
$\rm B$.图示电离最外层一个电子所需能量为$\rm Mg$的第一电离能;
$\rm C$.图示为镁原子激发态,容易失去一个电子;
$\rm D$.图示为$\rm Mg^{+}$激发态,较$\rm A$项容易失去一个电子;
综上,电离最外层一个电子所需能量最大的是$\rm A$;
乙二胺$\left( {{\text{H}}_{2}}\text{NC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{N}{{\text{H}}_{2}} \right)$是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与$\text{M}{{\text{g}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$等金属离子形成稳定环状离子,乙二胺中提供孤电子对的是 原子$\rm ($填名称$\rm )$,其中与乙二胺形成的化合物稳定性相对较高的是 $\rm ($填“$\text{M}{{\text{g}}^{2+}}$”或“$\text{C}{{\text{u}}^{2+}}$”$\rm )$。
$\\rm sp^{3}$ ; $\\rm sp^{3}$ ; $\\rm N$ ; $\\rm Cu^{2+}$
"]]在该有机物中,氮原子周围形成三个单键,且存在一个孤电子对,因此氮的杂化类型为$\rm sp^{3}$杂化;碳原子周期形成四个单键,因此碳的杂化类型为$\rm sp^{3}$杂化;
乙二胺中的两个$\rm N$提供孤电子对给金属离子形成稳定的配位键,故答案为$\rm N$原子;
由于$\rm Cu^{2+}$的半径大于$\rm Mg^{2+}$的半径,因此$\rm Cu^{2+}$与乙二胺形成的配合物稳定性相对较高;
一些氧化物的熔点如下表所示:
| 氧化物 | $\text{L}{{\text{i}}_{2}}\text{O}$ | $\text{MgO}$ | ${{\text{P}}_{4}}{{\text{O}}_{6}}$ | $\text{S}{{\text{O}}_{2}}$ |
| 熔点$/\text{ }{}^\circ \text{C}$ | $\rm 1570$ | $\rm 2800$ | $\rm 23.8$ | $-75.5$ |
请解释表中非金属氧化物之间熔点差异的原因 。
$\\rm Li_{2}O$和$\\rm MgO$为离子晶体,$\\rm P_{4}O_{6}$和$\\rm SO_{2}$为分子晶体,晶格能$\\rm MgO\\gt Li_{2}O$,分子间作用力$\\rm P_{4}O_{6}\\gt SO_{2}$
"]]$\rm Li_{2}O$和$\rm MgO$为离子晶体,$\rm P_{4}O_{6}$和$\rm SO_{2}$为分子晶体,离子晶体的熔点比分子晶体的熔点高;在离子晶体中,晶格能越大,熔点越高,由于晶格能$\rm MgO\gt Li_{2}O$,因此$\rm MgO$的熔点高于$\rm Li_{2}O$;在分子晶体中,分子间作用力越大,熔点越高,由于分子间作用力$\rm P_{4}O_{6}\gt SO_{2}$, 因此$\rm P_{4}O_{6}$的熔点高于$\rm SO_{2}$;
图$\left( \text{a} \right)$是$\text{MgC}{{\text{u}}_{2}}$的拉维斯结构,$\text{Mg}$以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的$\text{Cu}$。图$\left( \text{b} \right)$是沿立方格子对角面取得的截图。可见,$\text{Mg}$原子之间最短距离$y=$ $\text{pm}$。设阿伏加德罗常数的值为${{N}_{\text{A}}}$,则$\text{MgC}{{\text{u}}_{2}}$的密度是 $\text{g}\cdot \text{c}{{\text{m}}^{-3}}\rm ($列出计算表达式$\rm )$。
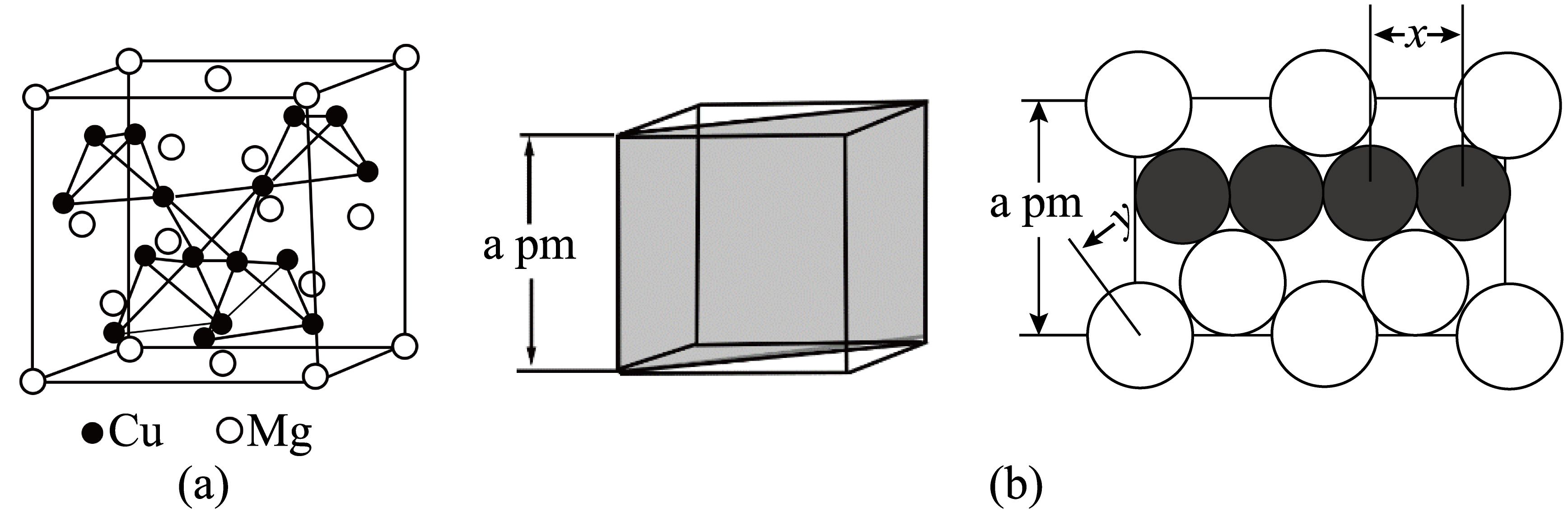
$\\dfrac{\\sqrt{\\text{3}}}{\\text{4}}a\\,\\text{pm}$ ; $\\dfrac{8\\times 24+16\\times 64}{{{N}_{\\text{A}}}{{a}^{3}}\\times {{10}^{-30}}}$
"]]如图所示, ,$\rm CD$距离为$y$,该长度为体对角线$\rm BC$长度的$\dfrac{1}{4}=\dfrac{1}{4}\times \sqrt{3}\times a\,\text{pm}=\dfrac{\sqrt{\text{3}}}{\text{4}}a\,\text{pm}$;该晶胞中$\rm Mg$原子位于$\rm 8$个顶点上,$\rm 6$个面心上,在晶胞内部有$\rm 4$个$\rm Mg$原子,所以$\rm Mg$原子个数$=8\times \dfrac{1}{8}+6\times \dfrac{1}{2}+4=8$,$\rm Cu$原子位于晶胞内部,有$\rm 16$个;晶胞体积$={{\text{(}a\times \text{1}{{\text{0}}^{\text{-10}}}\,\text{cm)}}^{\text{3}}}$,晶胞密度$=\dfrac{m}{V}=\dfrac{\dfrac{8\times 24+16\times 64}{{{N}_{\text{A}}}}}{{{(a\times {{10}^{-10}})}^{3}}}\,\text{g/c}{{\text{m}}^{\text{3}}}=\dfrac{8\times 24+16\times 64}{{{N}_{\text{A}}}{{a}^{3}}\times {{10}^{-30}}}\,\text{g/c}{{\text{m}}^{\text{3}}}$。
,$\rm CD$距离为$y$,该长度为体对角线$\rm BC$长度的$\dfrac{1}{4}=\dfrac{1}{4}\times \sqrt{3}\times a\,\text{pm}=\dfrac{\sqrt{\text{3}}}{\text{4}}a\,\text{pm}$;该晶胞中$\rm Mg$原子位于$\rm 8$个顶点上,$\rm 6$个面心上,在晶胞内部有$\rm 4$个$\rm Mg$原子,所以$\rm Mg$原子个数$=8\times \dfrac{1}{8}+6\times \dfrac{1}{2}+4=8$,$\rm Cu$原子位于晶胞内部,有$\rm 16$个;晶胞体积$={{\text{(}a\times \text{1}{{\text{0}}^{\text{-10}}}\,\text{cm)}}^{\text{3}}}$,晶胞密度$=\dfrac{m}{V}=\dfrac{\dfrac{8\times 24+16\times 64}{{{N}_{\text{A}}}}}{{{(a\times {{10}^{-10}})}^{3}}}\,\text{g/c}{{\text{m}}^{\text{3}}}=\dfrac{8\times 24+16\times 64}{{{N}_{\text{A}}}{{a}^{3}}\times {{10}^{-30}}}\,\text{g/c}{{\text{m}}^{\text{3}}}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
