高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
工业上用焦炭还原石英砂制得含有少量杂质的粗硅,将粗硅通过化学方法进一步提纯,可以得到高纯硅。回答下列问题。
石英砂制粗硅的化学方程式为 。
$2\\text{C}+\\text{Si}{{\\text{O}}_{2}}\\begin{matrix} \\underline{\\underline{高温 }} \\\\ {} \\\\\\end{matrix}\\text{Si}+2\\text{CO}\\uparrow $
"]]焦炭还原石英砂制得含有少量杂质的粗硅,化学方程式为$2\text{C}+\text{Si}{{\text{O}}_{2}}\begin{matrix} \underline{\underline{高温 }} \\ {} \\\end{matrix}\text{Si}+2\text{CO}\uparrow $;
处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
在基态$^{14}\text{C}$原子中,核外存在 对自旋相反的电子。
电子云 ; $\\rm 2$
"]]处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云表示;$^{14}\text{C}$电子式为$\rm 1s^{2}2s^{2}2p^{2}$,$\rm 1s$和$\rm 2s$电子自旋相反;
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示。
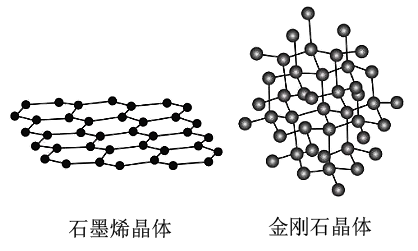
①在石墨烯晶体中,每个六元环占有 个$\rm C$原子。
②写出金刚石的硬度大于晶体硅的原因: 。
$\\rm 2$ ; 金刚石与晶体硅都属于共价晶体,半径$\\text{C}\\lt \\text{Si}$,键长$\\text{C}-\\text{C}\\lt \\text{Si}-\\text{Si}$,键长越短,键能越大,硬度越大
"]]①在石墨烯晶体中,每个碳原子被$\rm 3$个环共有,所以每个六元环占有$\rm 2$个碳原子,故答案为$\rm 2$。
②金刚石与晶体硅都属于共价晶体,半径$\text{C}\lt \text{Si}$,键长$\text{C}-\text{C}\lt \text{Si}-\text{Si}$,键长越短,键能越大,硬度越大,所以金刚石的硬度大于晶体硅。
$\text{Si}{{\text{O}}_{2}}$的晶体类型是 晶体,一种$\text{Si}{{\text{O}}_{2}}$晶体的结构中由顶角相连的硅氧四面体形成螺旋上升的长链如图所示。其中$\text{Si}$原子的杂化轨道类型是 。
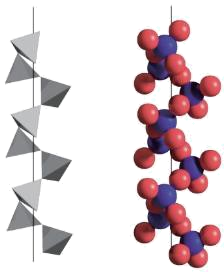
原子 ; $\\text{s}{{\\text{p}}^{3}}$
"]]$\text{Si}{{\text{O}}_{2}}$的晶体原子晶体;一个$\text{Si}$原子与$\rm 4$个$\rm O$原子相连,$\text{Si}$原子的杂化轨道类型是$\text{s}{{\text{p}}^{3}}$;
${{\text{H}}_{2}}$还原气态$\text{SiC}{{\text{l}}_{4}}$可制得纯硅,$1100\ {}^\circ \text{C}$时每生成$0.56\text{ kg}$纯硅需吸收$a\text{ kJ}$热量,写出该反应的热化学方程式: 。
$\\text{SiC}{{\\text{l}}_{4}}(\\text{g})+2{{\\text{H}}_{2}}(\\text{g})\\begin{matrix} \\underline{\\underline{1100\\ {}^\\circ \\text{C}}} \\\\ {} \\\\ \\end{matrix}\\text{Si}(\\text{s})+4\\text{HCl}(\\text{g})\\quad \\Delta H=+0.05a\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]${{\text{H}}_{2}}$还原气态$\text{SiC}{{\text{l}}_{4}}$可制得纯硅,$1100\ {}^\circ \text{C}$时每生成$0.56\text{ kg}$纯硅需吸收$a\text{ kJ}$热量,热化学方程式为$\text{SiC}{{\text{l}}_{4}}(\text{g})+2{{\text{H}}_{2}}(\text{g})\begin{matrix} \underline{\underline{1100\ {}^\circ \text{C}}} \\ {} \\ \end{matrix}\text{Si}(\text{s})+4\text{HCl}(\text{g})\quad \Delta H=+0.05a\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
高中 | 杂化轨道理论题目答案及解析(完整版)
