高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以$\rm C{{O}_{2}}$和$\rm N{{H}_{3}}$为原料合成尿素${\rm 2N{{H}_{3}}(g)+C{{O}_{2}}(g)\rightleftharpoons CO{{(N{{H}_{2}})}_{2}}(s)+{{H}_{2}}O(g)}\quad\Delta H=-87\rm \ kJ/mol$。
有利于提高$\rm C{{O}_{2}}$平衡转化率的措施是 $\rm ($填序号$\rm )$。
$\rm A$.高温低压
$\rm B$.低温高压
$\rm C$.高温高压
$\\rm B$
"]]由${\rm 2N{{H}_{3}}(g)+C{{O}_{2}}(g)\rightleftharpoons CO{{(N{{H}_{2}})}_{2}}(s)+{{H}_{2}}O(g)}\quad\Delta H=-87\rm \ kJ/mol$可知,该正反应方向为气体体积减小的放热反应,因此低温高压有利于平衡正向移动,二氧化碳的转化率提高。
研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
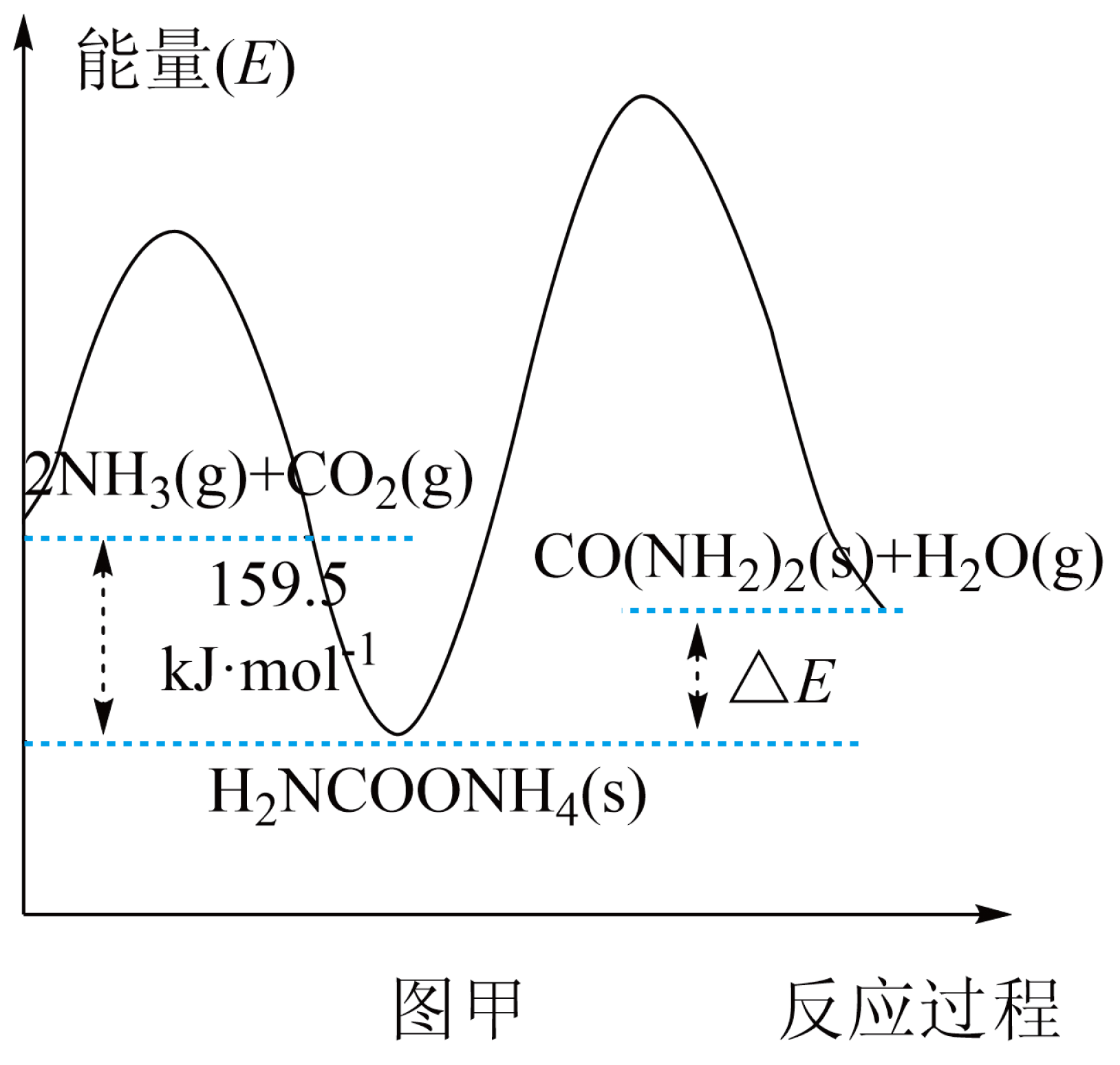
第一步:${\rm 2N{{H}_{3}}(g)+C{{O}_{2}}(g)\rightleftharpoons N{{H}_{2}}COON{{H}_{4}}(s)}\quad\Delta{{H}_{1}}$
第二步:${\rm N{{H}_{2}}COON{{H}_{4}}(s)\rightleftharpoons CO{{(N{{H}_{2}})}_{2}}(s)+{{H}_{2}}O(g)}\quad\Delta{{H}_{2}}$
①图中$\Delta E=$ $\rm \ kJ/mol$。
②反应速率较快的是 反应$\rm ($填“第一步”或“第二步”$\rm )$。
$\\rm 72.5$;第一步
"]]①已知${\rm 2N{{H}_{3}}(g)+C{{O}_{2}}(g)\rightleftharpoons CO{{(N{{H}_{2}})}_{2}}(s)+{{H}_{2}}O(g)}\quad\Delta H=-87\rm \ kJ/mol$,由图可知,$\Delta E=159.5\rm \ kJ/mol-87\ kJ/mol=72.5\ kJ/mol$。
②由图可知,第一步的活化能比第二步小,活化能越小,反应速率越快,则反应速率较快的是第一步反应。
Ⅱ.以$\rm C{{O}_{2}}$和$\rm C{{H}_{4}}$催化重整制备合成气:${\rm C{{O}_{2}}(g)+C{{H}_{4}}(g)\rightleftharpoons 2CO(g)+2{{H}_{2}}(g)}\quad \Delta H=+247\rm \ kJ/mol$。
在密闭容器中通入物质的量均为$\rm 0.2\ mol$的$\rm C{{H}_{4}}$和$\rm C{{O}_{2}}$,在一定条件下发生反应$\rm C{{H}_{4}}(g)+C{{O}_{2}}(g)\rightleftharpoons 2CO(g)+2{{H}_{2}}(g)$,$\rm C{{H}_{4}}$的平衡转化率随温度、压强的变化关系如图乙所示。
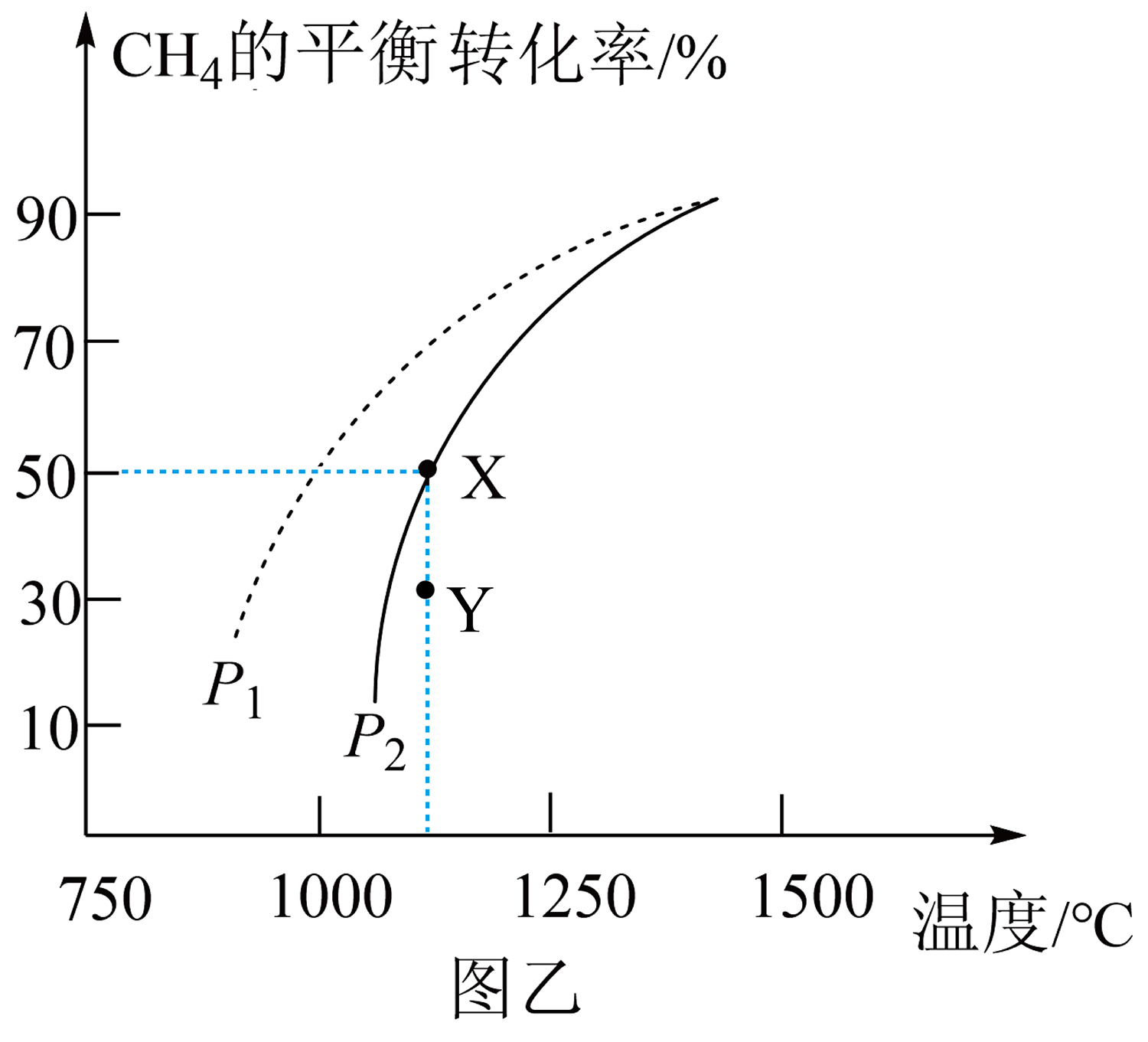
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是 $\rm ($填序号$\rm )$。
$\rm A$.容器中混合气体的密度保持不变
$\rm B$.容器内混合气体的压强保持不变
$\rm C$.反应速率:$2{{v}_{正}}{\rm (C{{O}_{2}})}={{v}_{逆}}\rm ({{H}_{2}})$
$\rm D$.同时断裂$\rm 2\ mol \ C-H$键和$\rm 1\ mol \ H-H$键
②由图乙可知,压强${{P}_{1}}$ ${{P}_{2}}($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”,下同$\rm )$;$\rm Y$点速率${{v}_{正}}$ ${{v}_{逆}}$。
③已知气体分压$\rm =$气体总压$\rm \times $气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数${{K}_{\rm p}}$,则$\rm X$点对应温度下的${{K}_{\rm p}}=$ $\rm ($用含${{P}_{2}}$的代数式表示$\rm )$。
$\\rm BD$;$\\rm \\lt $;$\\rm \\gt $;$\\dfrac{4}{9}{p_{2}}^{2}$
"]]①$\rm A$.在恒温、恒容密闭容器中发生$\rm C{{H}_{4}}(g)+C{{O}_{2}}(g)\rightleftharpoons 2CO(g)+2{{H}_{2}}(g)$,参加反应的各组分都是气体,密度不变不能说明反应达到平衡,$\rm A$错误。
$\rm B$.反应正向气体体积增大,恒容容器中,压强随着反应正向进行而增大,压强不变时说明各组分的含量不再变化反应达到平衡,$\rm B$正确。
$\rm C$.${{v}_{正}}\rm (C{{O}_{2}})$和${{v}_{逆}}\rm ({{H}_{2}})$均表示正反应速率,化学反应速率之比等于化学计量数之比,任意时刻都有$2{{v}_{正}}{\rm (C{{O}_{2}})}={{v}_{逆}}\rm ({{H}_{2}})$,不能说明反应达到平衡,$\rm C$错误。
$\rm D$.断裂$\rm 2\ mol\ C-H$键时生成$\rm 1\ mol\ H-H$键,同时又断裂$\rm 1\ mol\ H-H$键,正反应速率等于逆反应速,反应达到平衡,$\rm D$正确。
②$\rm C{{H}_{4}}(g)+C{{O}_{2}}(g)\rightleftharpoons 2CO(g)+2{{H}_{2}}(g)$反应正向气体体积增大,增大压强,平衡逆向移动,甲烷的转化率减小,结合图中信息可知,$p_{1}\lt p_{2}$;$\rm Y$点甲烷转化率低于平衡时转化率,反应正向进行,$v_{正}\gt v_{逆}$。
③$\rm X$点对应温度下甲烷的平衡转化率为$\rm 50\%$,可列三段式:
$\rm \begin{matrix} {} \\ 起始\rm (mol) \\ 转化\rm (mol) \\ 平衡\rm (mol) \\ \end{matrix}\begin{matrix} \rm C{{H}_{4}}(g) & + & \rm C{{O}_{2}}(g) & \rightleftharpoons & \rm 2CO(g) & + & \rm 2{{H}_{2}}(g) \\ 0.2 & {} & 0.2 & {} & 0 & {} & 0 \\ 0.1 & {} & 0.1 & {} & 0.2 & {} & 0.2 \\ 0.1 & {} & 0.1 & {} & 0.2 & {} & 0.2 \\ \end{matrix}$
平衡常数$K_{\rm p}=\dfrac{{{(\dfrac{0.2}{0.1+0.1+0.2+0.2}\times {{p}_{2}})}^{2}}{{(\dfrac{0.2}{0.1+0.1+0.2+0.2}\times {{p}_{2}})}^{2}}}{(\dfrac{0.1}{0.1+0.1+0.2+0.2}\times {{p}_{2}})(\dfrac{0.1}{0.1+0.1+0.2+0.2}\times {{p}_{2}})}=\dfrac{4}{9}{p_{2}}^{2}$。
同温下,某研究小组分别在容积相等的两个恒容密闭容器中加入一定量的反应物,控制反应条件使其仅发生$\rm C{{H}_{4}}-C{{O}_{2}}$重整反应,获得如下效据:
| 容器编号 | 起始时各物质的物质的量$\rm /mol$ | $\rm C{{H}_{4}}$平衡转化率 | 达到平衡时体系的压强$\rm /MPa$ | 达到平衡时体系能量的变化 | |||
| $\rm C{{H}_{4}}$ | $\rm C{{O}_{2}}$ | $\rm CO$ | $\rm {{H}_{2}}$ | ||||
| $\rm i$ | $\rm 1$ | $\rm 2$ | $\rm 0$ | $\rm 0$ | $P$ | 吸收热量:$\rm 123.5\ {kJ}$ | |
| $\rm ii$ | $\rm 2$ | $\rm 4$ | $\rm 0$ | $\rm 0$ | $\rm \alpha $ | ||
①容器$\rm i$中反应达到平衡时,生成$\rm CO$的物质的量为 ,容器$\rm ii$中反应达到平衡状态过程中吸收的热量 $\rm 247\ kJ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
②容器$\rm i$的容积变为原来的一半,则$\rm C{{H}_{4}}$平衡转化率 $\rm \alpha ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm 1\\ mol$;$\\rm \\lt $;$\\rm =$
"]]①已知${\rm C{{H}_{4}}(g)+C{{O}_{2}}(g)=2CO(g)+2{{H}_{2}}(g)}\quad\Delta H=+247\rm \ kJ/mol$,即生成$\rm 2\ mol\ CO$时放出$\rm 247\ kJ$热量,容器ⅰ放出热量$\rm 123.5\ kJ$,即生成的$\rm CO$为$\rm 1\ mol$;容器$\rm ii$的投料为容器ⅰ的$\rm 2$倍,在恒温恒容的容器中相当于增大压强,平衡会逆向移动,即生成$\rm CO$小于$\rm 2\ mol$,所以放出的热量会小于$\rm 247\ kJ$。
②容器ⅰ的体积若变成原来的一半,则与容器$\rm ii$的压强相等,二者为等效平衡,故转化率等于容器$\rm ii$。
高中 | 化学平衡常数题目答案及解析(完整版)
