高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
化学反应速率和限度与生产、生活密切相关。
某学生为了探究锌与盐酸反应过程中的速率变化,在$\rm 400$ $\rm mL$稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下$\rm ($累计值$\rm )$:
| 时间$\rm /min$ | $\rm 1$ | $\rm 2$ | $\rm 3$ | $\rm 4$ | $\rm 5$ |
| 氢气体积$\rm /mL($标准状况$\rm )$ | $\rm 100$ | $\rm 240$ | $\rm 464$ | $\rm 576$ | $\rm 620$ |
①各时间段反应速率最大的是 $\rm ($填“$\rm 0$~$\rm 1$”“$\rm 1$~$\rm 2$”“$\rm 2$~$\rm 3$”“$\rm 3$~$\rm 4$”或“$\rm 4$~$\rm 5$”$\rm )min$,原因是 。
②求$\rm 3$~$\rm 4$ $\rm min$时间段以盐酸的浓度变化来表示的该反应速率为 $\rm ($设溶液体积不变$\rm )$。
$\\rm 2$~$\\rm 3$ ; 该反应是放热反应,此时温度高且盐酸浓度较大,故反应速率较快 ; $\\rm 0.025$ $\\rm mol·L^{-1}·min^{-1}$
"]]①相同通条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是$\rm 2$~$\rm 3$ $\rm min$,原因是:该反应是放热反应,温度越高,反应速率越大;该反应是放热反应,此时温度高,反应速率越大;
②$\rm 3$~$4$分钟时间段,收集的氢气体积$\rm =(576-464)$ $\rm mL=112$ $\rm mL$, $n\left( {{\text{H}}_{2}} \right)=\dfrac{V}{{{V}_{\text{m}}}}=\dfrac{{0}{.112\;\rm L}}{{22}{.4\;\rm L/mol}}=0.005\,\text{mol}$,根据氢气和$\rm HCl$关系式得消耗的$n\left( \text{HCl} \right)=2\left( {{\text{H}}_{2}} \right)=2\times 0.005\,\text{mol}=0.01\,\text{mol}$,则$v(\text{HCl})=\dfrac{\Delta n}{V\Delta t}=\dfrac{\text{0}{.01}\,\text{mol}}{{0}{.4}\,\text{L}\times {1\;\rm min}}=0.025\text{ mol}/(\text{L}\cdot \text{min})$;
另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 $\rm ($填字母$\rm )$。
$\rm A$.蒸馏水 $\rm B$.$\rm KCl$溶液 $\rm C$.$\rm KNO_{3}$溶液 $\rm D$.$\rm CuSO_{4}$溶液
$\\rm CD$
"]]$\rm A$.加入蒸馏水,氢离子浓度减小,反应速率降低,故$\rm A$不选;
$\rm B$.加入$\rm KCl$溶液,氢离子浓度降低,反应速率降低,故$\rm B$不选;
$\rm C$.加入$\rm KNO_{3}$溶液,相当于含有硝酸,硝酸和$\rm Zn$反应生成$\rm NO$而不是氢气,故$\rm C$选;
$\rm D$.加入$\rm CuSO_{4}$溶液,$\rm Zn$和铜离子反应生成$\rm Cu$,$\rm Zn$、$\rm Cu$和稀盐酸构成原电池而加快反应速率,故$\rm D$选;
某温度下,在$\rm 4$ $\rm L$密闭容器中,$\rm X$、$\rm Y$、$\rm Z$三种气态物质的物质的量随时间变化曲线如图。
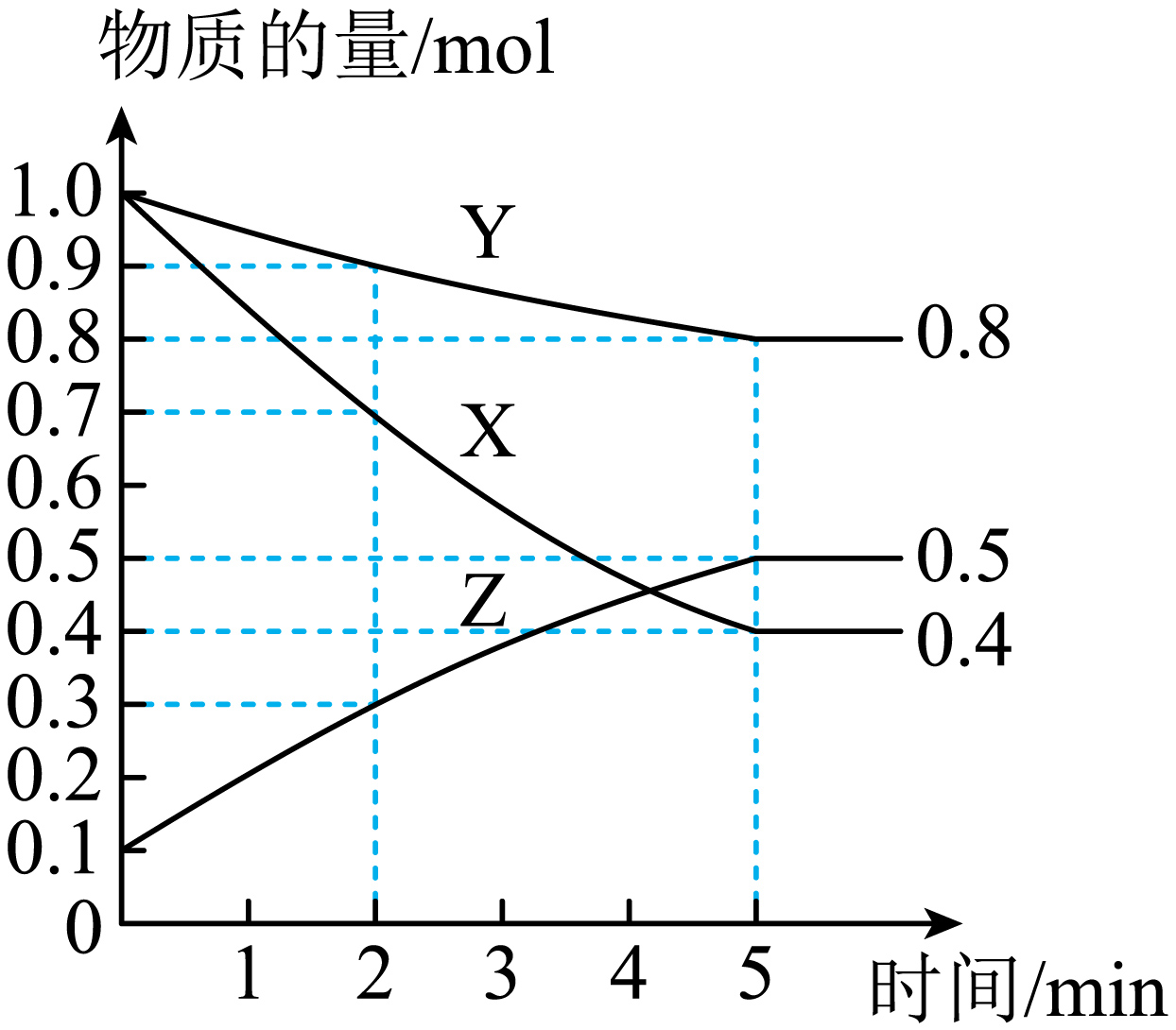
①该反应的化学方程式是 。
②该反应达到平衡状态的标志是 $\rm ($填字母$\rm )$。
$\rm A$.$\rm Y$的体积分数在混合气体中保持不变
$\rm B$.$\rm X$、$\rm Y$的反应速率比为$\rm 3$∶$\rm 1$
$\rm C$.容器内气体压强保持不变
$\rm D$.容器内气体的总质量保持不变
$\rm E$.生成$\rm 1$ $\rm mol$ $\rm Y$的同时消耗$\rm 2$ $\rm mol$ $\rm Z$
③$\rm 2$ $\rm min$内$\rm Y$的转化率为 。
$3\\text{X}(\\text{g})+\\text{Y}(\\text{g})\\rightleftharpoons 2\\text{Z}(\\text{g})$ ; $\\rm AC$ ; $\\rm 10\\%$
"]]①根据图知,随着反应进行,$\rm X$、$\rm Y$的物质的量减少而$\rm Z$的物质的量增加,则$\rm X$和$\rm Y$是反应物而$\rm Z$是生成物,反应达到平衡时,$\Delta n\left( \text{X} \right)=\left( 1.0-0.4 \right)\text{mol}=0.6\,\text{mol}$、$\Delta n(\text{Y})=\left( 1.0-0.8 \right)\,\text{mol}=0.2\,\text{mol}$、$\Delta n(\text{Z})=(0.5-0.1)\,\text{mol}=0.4\,\text{mol}$,同一可逆反应中同一段时间内参加反应的各物质的物质的量变化量之比等于其计算之比,$\rm X$、$\rm Y$、$\rm Z$的计量数之比$\rm =0.6$ $\rm mol$:$\rm 0.2$ $\rm mol$:$\rm 0.4$ $\rm mol=3$:$\rm 1$:$\rm 2$,则该反应方程式为$3\text{X}+\text{Y}\rightleftharpoons \text{2Z}$;
②$\rm A$.$\rm A$.$\rm Y$的体积分数在混合气体中保持不变,说明各物质的量不变,反应达到平衡状态,故$\rm A$正确;
$\rm B$.$\rm X$、$\rm Y$的反应速率比为$\rm 3$:$\rm 1$时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故$\rm B$错误;
$\rm C$.反应前后气体压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故$\rm C$正确;
$\rm D$.容器内气体的总质量一直保持不变,故$\rm D$错误;
$\rm E$.只要反应发生就有生成$\rm 1$ $\rm mol$ $\rm Y$的同时消耗$\rm 2$ $\rm mol$ $\rm Z$,故$\rm E$错误;
③$\rm Y$的转化率$ =\dfrac{\Delta n(\text{Y})}{n}=\dfrac{1-0.9}{1}\rm \times 100\%=10\%$。
高中 | 转化率、产率题目答案及解析(完整版)
