| 盐类水解常数 题目答案及解析
稿件来源:高途
| 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
“钠碱法”与“钙碱法”都是常见的$\rm SO_{2}$处理方案。钠碱法即利用$\rm NaOH$溶液吸收$\rm SO_{2}$,一般形成$\rm Na_{2}SO_{3}$与$\rm NaHSO_{3}$的混合液;钙碱法即利用消石灰悬浊液吸收。
用$\rm 150$ $\rm g$质量分数为$\rm 40.0\%$的$\rm NaOH$溶液吸收$\rm SO_{2}$,最多可吸收 $\operatorname{L}\rm ($折算到标准状况下$\rm )$;此时溶液中的主要溶质是 $\rm ($填化学式$\rm )$。
$\\rm 33.6$ ; $\\rm NaHSO_{3}$
"]]根据反应方程式:$\rm 2NaOH+SO_{2}=Na_{2}SO_{3}+H_{2}O$、$\rm NaOH+SO_{2}=NaHSO_{3}$可知,用$\rm 150\;\rm g$质量分数为$\rm 40.0\%$的$\rm NaOH$溶液吸收$\rm SO_{2}$,最多可吸收$\dfrac{150\,\text{g}\times 40.0\%}{40\,\text{g/mol}}\times 22.4\,\text{L/mol}=33.6\,\text{L}$;此时溶液中的主要溶质是$\rm NaHSO_{3}$;
如图是常温下一定量$\rm SO_{2}$通入一定浓度的$\rm NaOH$溶液后含硫微粒分布系数随$\rm pH$的关系图$\rm ($已知:含硫微粒$\operatorname{X}$的分布系数$=\dfrac{\left[ \text{X} \right]}{\left[ {{\text{H}}_{2}}\text{S}{{\text{O}}_{3}}\left] + \right[\text{HSO}_{3}^{-}\left] + \right[\text{SO}_{3}^{2-} \right]}\rm )$。基于该图可得该条件下亚硫酸的一级电离常数为 $\rm ($以$1.0\times {{10}^{x}}$的形式表示,下同$\rm )$;$\rm SO_{\text{3}}^{\text{2}-}$的水解平衡常数为 。
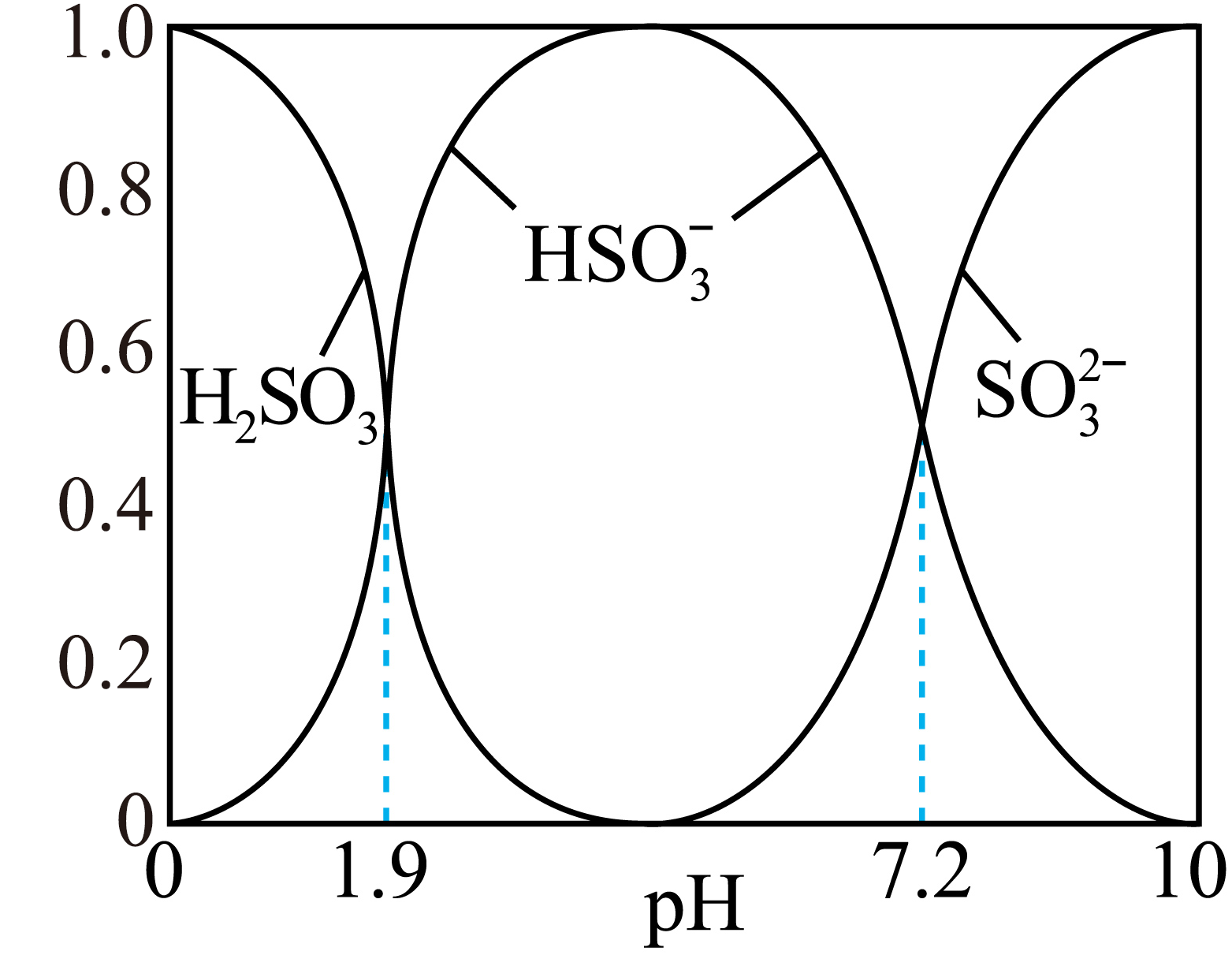
$\\rm 1.0\\times 10^{-1.9}$ ; $\\rm 1.0\\times 10^{-6.8}$
"]]由题干图像信息可知,当$\rm pH=1.9$时, $c\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)=c(\text{HSO}_{\text{3}}^{-})$,故该条件下亚硫酸的一级电离常数为: ${{K}_{{{\text{a}}_{\text{1}}}}}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)=\dfrac{c\text{(}{{\text{H}}^{+}}\text{)}c\text{(HSO}_{\text{3}}^{-}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}\text{)}}=c\left( {{\text{H}}^{+}} \right)=1.0\times {{10}^{-1.9}}$,同理可知,${{K}_{{{\text{a}}_{\text{2}}}}}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{3}} \right)=1.0\times {{10}^{-7.2}}$,$SO_{\text{3}}^{\text{2}-}$的水解平衡常数为: ${{K}_{\text{h1}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{{{\text{a}}_{\text{2}}}}}({{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{3}})}=\dfrac{{{10}^{-14}}}{{{10}^{-7.2}}}\rm =1.0\times 10^{-6.8}$;
若某浓度的$\rm NaOH$溶液吸收了$\rm 0.1$ $\rm mol$ $\rm SO_{2}$,且吸收后$\text{pH}=7$,则$c\left( \text{N}{{\text{a}}^{+}} \right)=c(\text{HSO}_{\text{3}}^{-})+$ $\rm ($用含硫微粒浓度的代数式表示$\rm )$。
$2c(\\text{SO}_{\\text{3}}^{\\text{2-}})$
"]]若某浓度的$\text{NaOH}$溶液吸收了$0.1\,\text{mol}\,\text{S}{{\text{O}}_{2}}$,根据电荷守恒可知: $c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=2c(\text{SO}_{\text{3}}^{\text{2-}})+c(\text{HSO}_{\text{3}}^{-})+c\left( \text{O}{{\text{H}}^{-}} \right)$,且吸收后$\text{pH}=7$,$c\left( {{\text{H}}^{+}} \right)=\text{ }c\left( \text{O}{{\text{H}}^{-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)=2c(\text{SO}_{\text{3}}^{\text{2-}})+c(\text{HSO}_{\text{3}}^{-})$;
用钙碱法吸收$\rm SO_{2}$后往往会生成$\rm CaSO_{3}$沉淀$\left( {{K}_{\text{sp}}}=3.1\times {{10}^{-7}} \right)$,将足量该沉淀置于$\rm 0.10$ $\rm mol/L$ $\rm Na_{2}SO_{3}$溶液中,求$c\left( \text{C}{{\text{a}}^{\text{2+}}} \right)$ $\rm ($写出过程$\rm )$: 。
将足量该沉淀置于$\\rm 0.10$ $\\rm mol/L$ $\\rm Na_{2}SO_{3}$溶液中,则溶液中$c(\\text{SO}_{\\text{3}}^{\\text{2-}})=0.10\\,\\text{mol/L}$,故$c\\left( \\text{C}{{\\text{a}}^{2+}} \\right)=\\dfrac{{{K}_{\\text{sp}}}\\text{(CaS}{{\\text{O}}_{\\text{3}}}\\text{)}}{c\\text{(SO}_{\\text{3}}^{\\text{2-}}\\text{)}}=\\dfrac{3.1\\times {{10}^{-7}}}{0.10}=3.1\\times {{10}^{-6}}\\,\\text{mol/L}$
"]]将足量该沉淀置于$\rm 0.10$ $\rm mol/L$ $\rm Na_{2}SO_{3}$溶液中,则溶液中$c(\text{SO}_{\text{3}}^{\text{2-}})=0.10\,\text{mol/L}$,故$c\left( \text{C}{{\text{a}}^{2+}} \right)=\dfrac{{{K}_{\text{sp}}}\text{(CaS}{{\text{O}}_{\text{3}}}\text{)}}{c\text{(SO}_{\text{3}}^{\text{2-}}\text{)}}=\dfrac{3.1\times {{10}^{-7}}}{0.10}=3.1\times {{10}^{-6}}\,\text{mol/L}$。
| 盐类水解常数题目答案及解析(完整版)
