| 盐类水解常数 题目答案及解析
稿件来源:高途
| 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
$\rm 25\;\rm ^\circ\rm C$时,向$\rm 100\;\rm mL$蒸馏水中加入$3\ \mathrm{g}\ {\mathrm{{CaCO}}}_{3}$粉末,一段时间后再向其中加入$\rm 10\;\rm mL$蒸馏水。该过程中电导率的变化如下图。
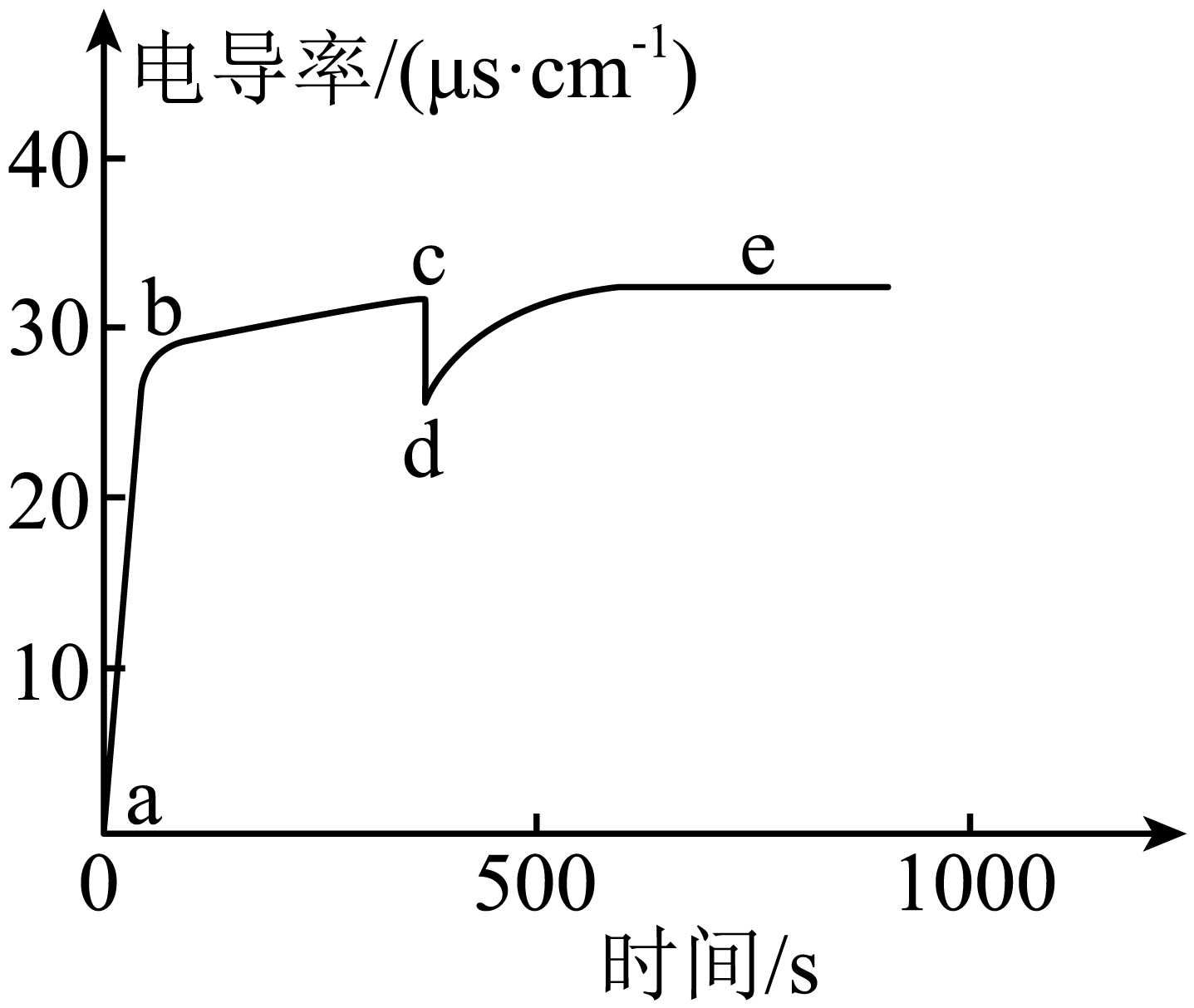
已知:$\rm 25\;\rm ^\circ\rm C$时,${{K}_{\text{sp}}}\left( \text{CaC}{{\text{O}}_{3}} \right)=3.4\times {{10}^{-9}}$;饱和$\text{CaC}{{\text{O}}_{3}}$溶液的$\rm pH$略小于$\rm 10$。${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$的电离常数:${{K}_{\text{a}1}}=4.5\times {{10}^{-7}}$,${{K}_{\text{a}2}}=4.7\times {{10}^{-11}}$。
下列说法正确的是$(\qquad)$
$\\rm a→b$过程的上层清液中存在$c\\left( \\text{C}{{\\text{a}}^{2+}} \\right)=c\\left( \\text{CO}_{3}^{2-} \\right)$
","$\\rm c→d$过程的上层清液电导率下降,说明$\\text{CaC}{{\\text{O}}_{3}}$的溶解平衡逆向移动
","$\\rm e$点后溶液的电导率几乎不再改变,可知上层清液中存在$c\\left( \\text{CO}_{3}^{2-} \\right)\\gt c\\left( \\text{HCO}_{3}^{-} \\right)$
","体系中任意时刻都满足:$2c\\left( \\text{C}{{\\text{a}}^{2+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right)=2c\\left( \\text{CO}_{3}^{2-} \\right)+c\\left( \\text{HCO}_{3}^{-} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
"]$\rm A$. $\rm a→b$过程,$\text{CaC}{{\text{O}}_{3}}$溶解后$\text{CO}_{3}^{2-}$水解,上层清液中存在$c\left( \text{C}{{\text{a}}^{2+}} \right)\gt c\left( \text{CO}_{3}^{2-} \right)$,$\rm A$错误;
$\rm B$.$\rm c→d$过程加入$\rm 10\;\rm mL$蒸馏水,上层清液电导率下降是因为溶液稀释,且溶液稀释会促进$\text{CaC}{{\text{O}}_{3}}$的溶解平衡正向移动,$\rm B$错误;
$\rm C$.$\rm e$点后溶液的电导率几乎不再改变,由${{K}_{\text{sp}}}\left( \text{CaC}{{\text{O}}_{3}} \right)=3.4\times {{10}^{-9}}$得$c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)=\sqrt{3.4\times 1{{0}^{-9}}}\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}\approx 6.0\times 1{{0}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{\text{-1}}}$,$\text{CO}_{3}^{2-}$存在水解平衡,即$\text{CO}_{\text{3}}^{\text{2-}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{HCO}_{\text{3}}^{-}\text{+O}{{\text{H}}^{-}}$,$\text{HCO}_{\text{3}}^{-}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons {{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{+O}{{\text{H}}^{-}}$,根据${{K}_{a2}}=4.7\times 1{{0}^{-11}}$可得$\dfrac{c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}=4.7\times {{10}^{-11}}$,则碳酸根离子的水解平衡常数${{K}_{\text{h1}}}=\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a2}}}}\approx 2\times {{10}^{-4}}$,$\text{CO}_{3}^{2-}$以第一步水解为主,设有$x\ \text{mol}\cdot {{\text{L}}^{-1}}$的$\text{CO}_{3}^{2-}$水解生成$\text{HCO}_{3}^{-}$,列三段式有:
$\begin{matrix} {} & \text{CO}_{\text{3}}^{\text{2-}} & + & {{\text{H}}_{\text{2}}}\text{O} & \rightleftharpoons & \text{HCO}_{\text{3}}^{-} & + & \text{O}{{\text{H}}^{-}} \\起始 \left( \text{mol}\cdot {{\text{L}}^{\text{-1}}} \right) & \text{6}\text{.0}\times \text{1}{{\text{0}}^{\text{-5}}} & {} & {} & {} & {} & {} & {} \\转化 \left( \text{mol}\cdot {{\text{L}}^{\text{-1}}} \right) & {x} & {} & {} & {} & {x} & {} & {x} \\平衡 \left( \text{mol}\cdot {{\text{L}}^{\text{-1}}} \right) & \text{6}\text{.0}\times \text{1}{{\text{0}}^{\text{-5}}}{-x} & {} & {} & {} & {x} & {} & {x} \\ \end{matrix}$
则$\dfrac{{{{x}}^{\text{2}}}}{\text{6}{.0}\times \text{1}{{\text{0}}^{\text{-5}}}{-x}}\approx \text{2}\times \text{1}{{\text{0}}^{\text{-4}}}$,$x\approx 4.85\times 1{{0}^{-5}}$,所以$c\left( \text{HCO}_{\text{3}}^{-} \right)\approx 4.85\times 1{{0}^{-5}}\;\rm mol\cdot {{L}^{-1}}$,$c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)\approx \text{1}\text{.15}\times \text{1}{{\text{0}}^{\text{-5}}}\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}$,$c\left( \text{HCO}_{\text{3}}^{-} \right)\gt c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)$,$\rm C$错误;
$\rm D$.根据电荷守恒,体系中任意时刻都满足:$2c\left( \text{C}{{\text{a}}^{2+}} \right)+c\left( {{\text{H}}^{+}} \right)=2c\left( \text{CO}_{3}^{2-} \right)+c\left( \text{HCO}_{3}^{-} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,$\rm D$正确;
故选:$\rm D$
| 盐类水解常数题目答案及解析(完整版)
