| 盐类水解常数 题目答案及解析
稿件来源:高途
| 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
室温下,用相同浓度的$\rm NaOH$溶液分别滴定$\rm 20\;\rm mL$ $\rm 0.1\;\rm mol·L^{-1}$的$\rm HX$、$\rm HY$两种酸溶液,测得溶液$\rm pH$与滴入$\rm NaOH$溶液体积的关系曲线如图所示。下列说法正确的是$(\qquad)$
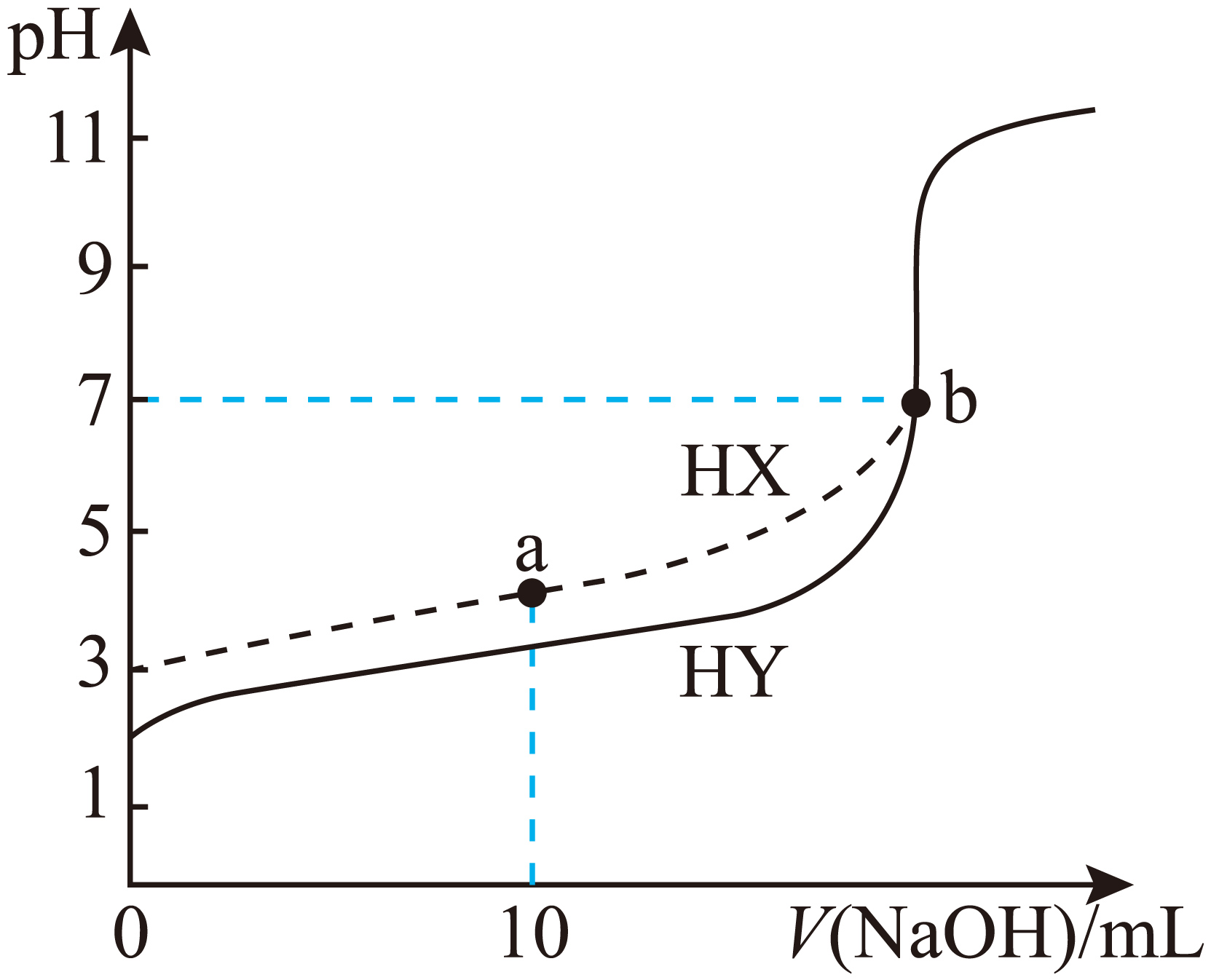
室温下酸根离子的水解常数:${{{K}}_{\\text{h}}}\\text{(}{{\\text{Y}}^{-}}\\text{)}\\gt {{{K}}_{\\text{h}}}\\text{(}{{\\text{X}}^{-}}\\text{)}$
","$\\rm a$点的溶液中:$c\\text{(}{{\\text{X}}^{-}} {)\\gt c\\rm(N}{{\\text{a}}^{+}} {)\\gt c\\rm(HX)}\\gt c( {{\\text{H}}^{+}} {)\\gt c\\rm(O}{{\\text{H}}^{-}}\\text{)}$
","$\\rm b$点是滴定终点
","可选用甲基橙作为指示剂
"]$\rm A$.由图像知,起始浓度相同时$\rm HY$溶液中$c\text{(}{{\text{H}}^{+}}\text{)}$较大,且$c\text{(}{{\text{H}}^{+}}\text{)}$小于$\rm 0.1\;\rm mol/L$,为弱酸,酸性:$\rm HY\gt HX$,酸性越弱,酸根离子的水解常数越大,即${{{K}}_{\text{h}}}\text{(}{{\text{Y}}^{-}}\text{)}\lt {{{K}}_{\text{h}}}\text{(}{{\text{X}}^{-}}\text{)}$,$\rm A$项错误;
$\rm B$.$\rm a$点时$\rm HX$被中和一半,溶液中的溶质为等物质的量浓度的酸$\rm (HX)$和盐$\rm (NaX)$,溶液呈酸性,则$c\text{(}{{\text{H}}^{+}} {)\gt c\rm(O}{{\text{H}}^{-}}\text{)}$,说明$\rm HX$的电离程度大于${{\text{X}}^{-}}$的水解程度,则$c\text{(}{{\text{X}}^{-}} {)\gt c\rm(HX)}$,由$ {2c\rm(N}{{\text{a}}^{+}} {)=c(}{{\text{X}}^{-}} {)+c\rm(HX)}$可知,$c\text{(}{{\text{X}}^{-}} {)\gt c\rm(N}{{\text{a}}^{+}} {)\gt c\rm(HX)}$,$\rm B$项正确;
$\rm C$.滴定终点时溶质为强碱弱酸盐,溶液$\rm pH\gt 7$,$\rm b$点不是滴定终点,$\rm C$项错误;
$\rm D$.由于滴定终点时溶液显碱性,故应选用酚酞作为指示剂,$\rm D$项错误。
故选:$\rm B$
| 盐类水解常数题目答案及解析(完整版)
