| 盐类水解常数 题目答案及解析
稿件来源:高途
| 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
亚砷酸$\rm (H_{3}AsO_{3})$可用于治疗急性早幼粒细胞白血病,可通过注射至血液的方式直接给药。医用的亚砷酸溶液可通过将$\rm As_{2}O_{3}$溶于过量$\rm NaOH$溶液后加稀硫酸配置。一般情况下,亚砷酸溶液中各种微粒的物质的量分数与$\rm pH$的关系如图所示。
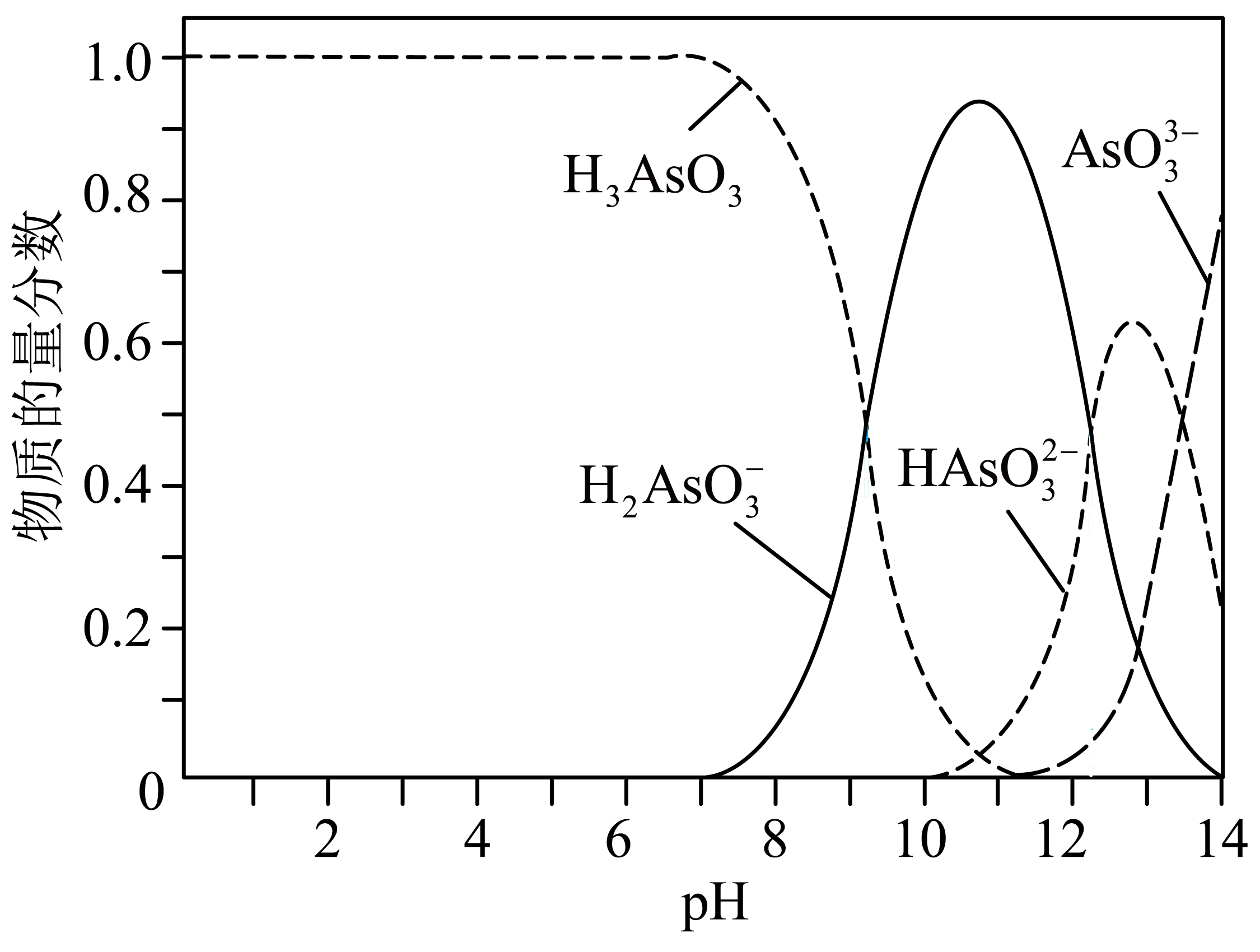
写出$\rm As_{2}O_{3}$溶于过量$\rm NaOH$溶液的离子方程式: 。
$\\rm As_{2}O_{3}$ $\\rm +$ $\\rm 6OH^{-}=$ $\\rm 2\\text{AsO}_{3}^{3-}$ $\\rm +$ $\\rm 3H_{2}O$
"]]从图中可以看出,$\rm As_{2}O_{3}$溶于过量$\rm NaOH$溶液,最终生成$\rm Na_{3}AsO_{3}$和水,离子方程式:$\rm As_{2}O_{3}$ $\rm +$ $\rm 6OH^{-}=$ $\rm 2\text{AsO}_{3}^{3-}$ $\rm +$ $\rm 3H_{2}O$。
将亚砷酸溶液注入一般情况下的血液后,砷元素的主要存在形式为 $\rm ($填微粒化学符号$\rm )$。
$\\rm H_{3}AsO_{3}$
"]]将亚砷酸溶液注入一般情况下的血液后,血液呈微弱的碱性,则砷元素的主要存在形式为$\rm H_{3}AsO_{3}$。
该条件下,$\text{HAsO}_{3}^{2-}$的电离平衡常数${{K}_{\text{a3}}}$与$\text{AsO}_{3}^{3-}$的水解平衡常数${{K}_{\text{h1}}}$的大小关系为${{K}_{\text{a3}}}$ ${{K}_{\text{h1}}}\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”,下同$\rm )$。对于$\rm 0.1$ $\rm mol/L$ $\rm Na_{2}HAsO_{3}$溶液而言, $c(\text{HAsO}_{3}^{2-})$ $c(\text{AsO}_{3}^{3-})$。
$\\rm \\lt $; $\\rm \\gt $
"]]该条件下,$\text{HAsO}_{3}^{2-}$的电离平衡常数${{K}_{\text{a3}}}=\dfrac{c({{\text{H}}^{+}})\cdot c(\text{AsO}_{3}^{3-})}{c(\text{HAsO}_{3}^{2-})}$,当$c(\text{HAsO}_{3}^{2-})=c(\text{AsO}_{3}^{3-})$时,$\rm pH$介于$\rm 12$~$\rm 14$之间,设为${{10}^{-a}}$,此时${{K}_{\text{a3}}}=c\left( {{\text{H}}^{+}} \right)=1\times {{10}^{-a}}$;$\text{AsO}_{3}^{3-}$的水解平衡常数${{K}_{\text{h1}}}=\dfrac{{{K}_{\text{W}}}}{{{K}_{\text{a3}}}}={{10}^{-(14-a)}}\gt 1\times {{10}^{-a}}$,所以${{K}_{\text{a3}}}\lt {{K}_{\text{h1}}}$。对于$\rm 0.1$ $\rm mol/L$ $\rm Na_{2}HAsO_{3}$溶液而言, ${{K}_{\text{a3}}}=\dfrac{c({{\text{H}}^{+}})\cdot c(\text{AsO}_{3}^{3-})}{c(\text{HAsO}_{3}^{2-})}=1\times {{10}^{-a}}\lt 1$ ,所以$c(\text{HAsO}_{3}^{2-})=c(\text{AsO}_{3}^{3-})$。
| 盐类水解常数题目答案及解析(完整版)
