高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
电极活性物质$\rm Cu_{4}O(PO_{4})_{2}$的制备,可通过下列反应制备:$\rm 2Na_{3}PO_{4}+4CuSO_{4}+2NH_{3}·H_{2}O$ $\rm =$ $\rm Cu_{4}O(PO_{4})_{2}↓+3Na_{2}SO_{4}+(NH_{4})_{2}SO_{4}+H_{2}O$。
上述反应涉及的元素中不属于元素周期表$\rm p$区元素的是 ,写出基态$\rm Cu^{2+}$的电子排布式 。
$\\rm H$、$\\rm Na$、$\\rm Cu$ ; $\\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}$或$\\rm [Ar]3d^{9}$
"]]上述反应涉及的元素有$\rm Cu$、$\rm O$、$\rm P$、$\rm Na$、$\rm S$、$\rm N$、$\rm H$,不属于元素周期表$\rm p$区元素的是$\rm H$、$\rm Na$、$\rm Cu$;铜原子失去$\rm 2$个电子得到铜离子,$\rm Cu^{2+}$核外有$\rm 27$个电子,根据核外电子排布规律,基态$\rm Cu^{2+}$的电子排布式是$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}$或$\rm [Ar]3d^{9}$。
$\rm P$、$\rm S$元素第一电离能大小关系为$\rm P$ $\rm S($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$,原因是 。
$\\rm \\gt $ ; $\\rm P$原子$\\rm 3p$轨道上的电子处于半充满状态,较稳定,比$\\rm S$难失去电子
"]]$\rm P$原子$\rm 3p$轨道上的电子处于半充满状态,结构稳定,比$\rm S$难失去电子,所以$\rm P$、$\rm S$元素第一电离能大小关系为$\rm P\gt S$。
$\rm O$的原子核外有 种不同能量的电子,其氢化物沸点高于同族元素$\rm H_{2}S$的原因是 。
$\\rm 3$ ; $\\rm H_{2}O$和$\\rm H_{2}S$均为结构相似的分子晶体,虽然分子量$\\rm H_{2}O$小于$\\rm H_{2}S$,范德华力较弱,但$\\rm H_{2}O$分子间能形成氢键,使得水分子间作用力大于$\\rm H_{2}S$,故沸点高于$\\rm H_{2}S$
"]]$\rm O$为$\rm 8$号元素,核外电子排布为$\rm 1s^{2}2s^{2}2p^{4}$,则原子核外有$\rm 3$种不同能量的电子;$\rm H_{2}O$和$\rm H_{2}S$均为结构相似的分子晶体,虽然分子量$\rm H_{2}O$小于$\rm H_{2}S$,范德华力较弱,但$\rm H_{2}O$分子间能形成氢键,使得水分子间作用力大于$\rm H_{2}S$,故沸点高于$\rm H_{2}S$;
$\rm CuSO_{4}$溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液$\rm [Cu(NH_{3})_{4}]SO_{4}$,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是 。
$\rm A$.该物质正离子的中心是$\rm Cu$原子 $\rm B$.该配合物的配体数等于配位数
$\rm C$.外界离子的中心原子的杂化方式为$\rm sp^{3}$ $\rm D$.乙醇的作用是将配合物转化为$\rm Cu(OH)_{2}$
写出沉淀溶解生成深蓝色溶液的离子方程式 。
$\\rm AD$ ; $\\rm Cu(OH)_{2}+4NH_{3}·H_{2}O=[Cu(NH_{3})_{4}]^{2+}+2OH^{-}+4H_{2}O$
"]]$\rm A$.该物质正离子的中心是$\rm Cu$离子而不是铜原子,铜离子提供空轨道和氮提供的孤电子对形成配位键,错误;
$\rm B$.该配合物的配体数等于铜离子的配位数,为$\rm 4$,正确;
$\rm C$.外界离子$\rm \text{SO}_{\text{4}}^{\text{2-}}$的中心原子$\rm S$原子的价层电子对数为$\rm 4+\dfrac{6+2\text{-2}\times 4}{2}=4$,为$\rm sp^{3}$杂化,正确;
$\rm D$.乙醇的作用是降低配合物的溶解度,使其析出,错误;
氢氧化铜沉淀和氨水反应生成配离子$\rm [Cu(NH_{3})_{4}]^{2+}$而溶解生成深蓝色溶液,同时生成氢氧根离子和水,离子方程式$\rm Cu(OH)_{2}+4NH_{3}·H_{2}O=[Cu(NH_{3})_{4}]^{2+}+2OH^{-}+4H_{2}O$;
在硫酸铜溶液中加入过量$\rm KCN$,生成配合物$\rm [Cu(CN)_{4}]^{2-}$,则$\rm 1$ $\rm mol$该配合物含有$\rm \pi$键的数目为 $({{N}_{\text{A}}}$表示阿伏加德罗常数的值$\rm )$。
$8N_{\\rm A}$
"]]单键均为$\rm \sigma$键,叁键含有$\rm 1$个$\rm \sigma$键$\rm 2$个$\rm \pi$键;$\rm CN^{-}$存在碳氮三键,$\rm 1$个碳氮三键中有$\rm 2$个$\rm \pi$键,所以$\rm 1$ $\rm mol$该配合物含有$\rm 8$ $\rm mol$ $\rm \pi$键,数目为$8{{N}_{\text{A}}}$。
晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为 ,已知铜原子半径为$\rm 127.8$ $\rm pm$,${{N}_{\text{A}}}=6.02\times {{10}^{23}}\,\text{mo}{{\text{l}}^{-\text{1}}}$,计算晶体铜的密度 $\rm g·cm^{-3}($结果保留$\rm 3$位有效数字$\rm )$。
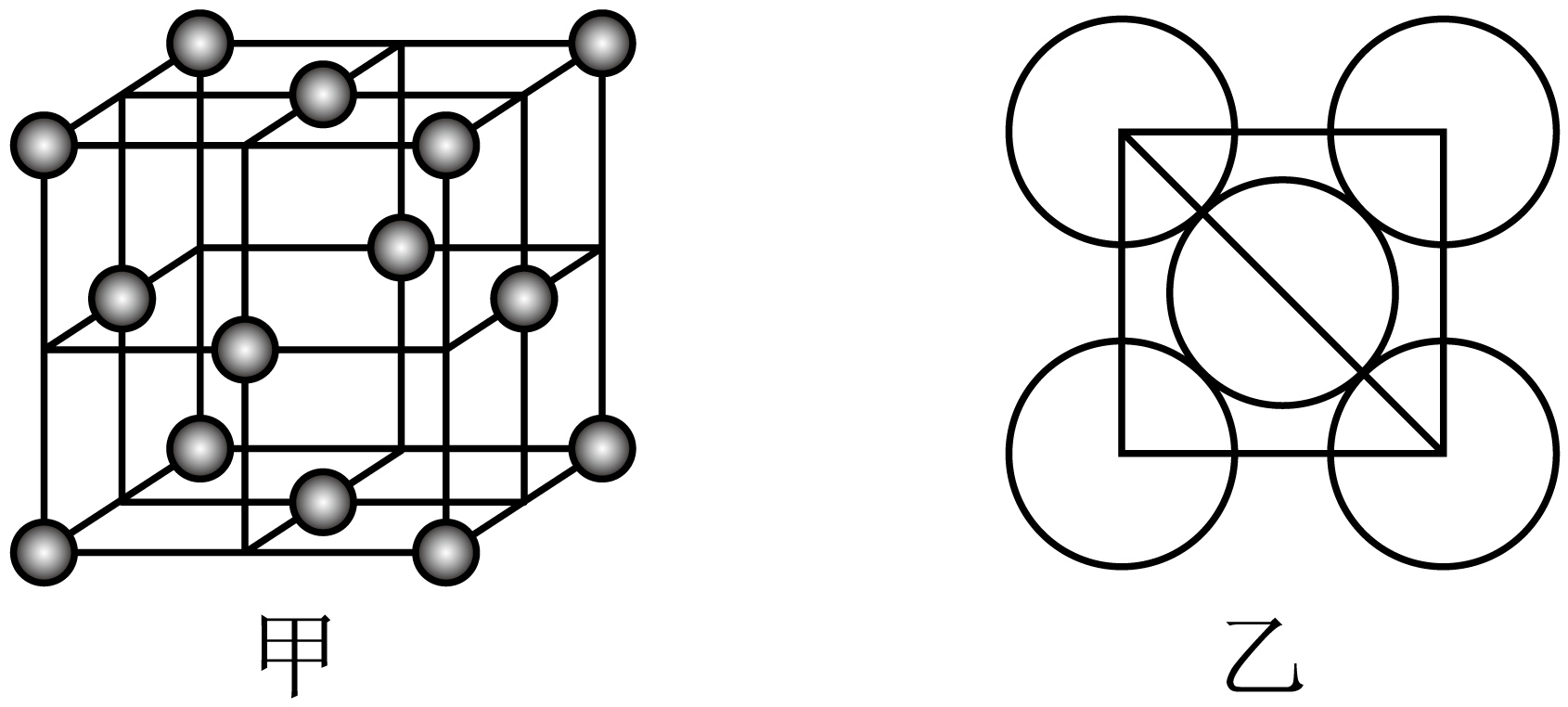
$\\rm 12$ ; $\\rm 9.00$
"]]离铜原子最近且距离相等的原子为铜原子的配位原子,根据图甲可知,以底面面心铜原子为例,同层、上下层各有$\rm 4$个配位原子,故铜原子配位数是$\rm 12$;根据图乙可知,晶胞的面对角线长为$\rm 127.8$ $\rm pm\times 4$,则晶胞棱长为$2\sqrt{2}\times 127.8\times {{10}^{\text{-10}}}\,\text{cm}$,根据“均摊法”,晶胞中含$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$个$\rm Cu$,则晶体密度为$\dfrac{\dfrac{4M}{{{N}_{\text{A}}}}}{{{\left( 2\sqrt{2}\times 127.8 \right)}^{\text{3}}}}\times {{10}^{30}}\,\text{g}\cdot \text{c}{{\text{m}}^{-3}}=\dfrac{4\times 64}{{{\left( 2\sqrt{2}\times 127.8 \right)}^{\text{3}}}{{N}_{\text{A}}}}\times {{10}^{30}}\,\text{g}\cdot \text{c}{{\text{m}}^{-3}}=9.00\,\text{g}\cdot \text{c}{{\text{m}}^{\text{-3}}}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
