高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
化学的发展支撑国家科技的进步。
Ⅰ.我国科研工作者发现并制备了一系列主要由$\rm N$、$\rm O$、$\rm P$、$\rm Se$等元素组成的导电材料。回答下列问题:
$\rm O$、$\rm P$、$\rm S$三种元素中,电负性最小的元素名称是 。
磷
"]]已知同一周期从左往右元素的电负性依次增强,同一主族从上往下元素的电负性依次减弱,故$\rm O$、$\rm P$、$\rm S$三种元素中,电负性最小的元素名称是磷;
肼$\rm ({{\text{H}}_{2}}\text{N}-\text{N}{{\text{H}}_{2}}\rm )$分子中孤电子对与$\sigma $键的数目之比为 。
$\\rm 2:5$
"]]已知氮原子最外层上有$\rm 5$个电子,有$\rm 3$个未成对电子,故肼分子上的每个氮原子上都还有$\rm 1$对孤电子对,且单键均为$\text{ }\!\!\sigma\!\!\text{ }$键,则肼$\rm (H_{2}N-NH_{2})$分子中孤电子对与$\text{ }\!\!\sigma$键的数目之比为$\rm 2:5$;
正硝酸钠$\rm (\text{N}{{\text{a}}_{3}}\text{N}{{\text{O}}_{4}}\rm )$是一种重要的化工原料。$\text{N}{{\text{a}}_{3}}\text{N}{{\text{O}}_{4}}$阴离子的空间结构为 其中心原子杂化方式为 杂化。
正四面体形 ;$\\rm sp^{3}$
"]]$\rm Na_{3}NO_{4}$阴离子即$\text{NO}_{\text{4}}^{\text{3-}}$中心原子$\rm N$周围的价层电子对数为:$\rm 4+\dfrac{\text{1}}{\text{2}}\times \text{(5+3-4}\times \text{2)}\rm =4$,根据价层电子对互斥理论可知,其空间结构为正四面体形,根据杂化轨道理论可知,其中心原子杂化方式为$\rm sp^{3}$杂化;
基态硒原子的价层电子排布式为 ;$\text{Se}{{\text{O}}_{2}}$晶体的熔点为$\rm 350\;\rm ^\circ\rm C$,加热易升华,固态$\text{Se}{{\text{O}}_{2}}$属于 晶体。
$\\rm 4s^{2}4p^{4}$ ;分子
"]]已知$\rm Se$是$\rm 34$号元素,故基态硒原子的价层电子排布式为$\rm 4s^{2}4p^{4}$;$\rm SeO_{2}$晶体的熔点为$\rm 350\;\rm ^\circ\rm C$较低,加热易升华,具有分子晶体的特征,即固态$\rm SeO_{2}$属于分子晶体;
Ⅱ.我国科研工作者利用甲硅烷$\rm (\text{Si}{{\text{H}}_{4}}\rm )$制备多种新型无机非金属材料。①热稳定性:$\text{Si}{{\text{H}}_{4}}$ $\text{N}{{\text{H}}_{3}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
②$\text{Si}{{\text{H}}_{4}}$中$\rm H-Si-H$的键角 $\text{N}{{\text{H}}_{3}}$中$\rm H-N-H$的键角$\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm \\lt $; $\\rm \\gt $
"]]①原子半径:$\rm N\lt Si$,则键长:$\rm H-N\lt Si-H$,且非金属性$\rm N\gt Si$,故键能:$\rm H-N\gt Si-H$,则热稳定性:$\rm SiH_{4}\lt NH_{3}$;
②$\rm SiH_{4}$中硅形成$\rm 4$个共价键无孤电子对,$\rm Si$为$\rm sp^{3}$杂化,$\rm H-Si-H$的键角为$\rm 109^\circ28^\prime$,$\rm NH_{3}$中氮形成$\rm 3$个共价键有$\rm 1$对孤电子对,$\rm N$也是$\rm sp^{3}$杂化,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,$\rm H-N-H$的键角为$\rm 107.3^\circ$,故$\text{Si}{{\text{H}}_{4}}$中$\rm H-Si-H$的键角$\rm \gt \text{N}{{\text{H}}_{3}}$中$\rm H-N-H$的键角;
利用$\text{Si}{{\text{H}}_{4}}$与$\text{C}{{\text{H}}_{4}}$反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
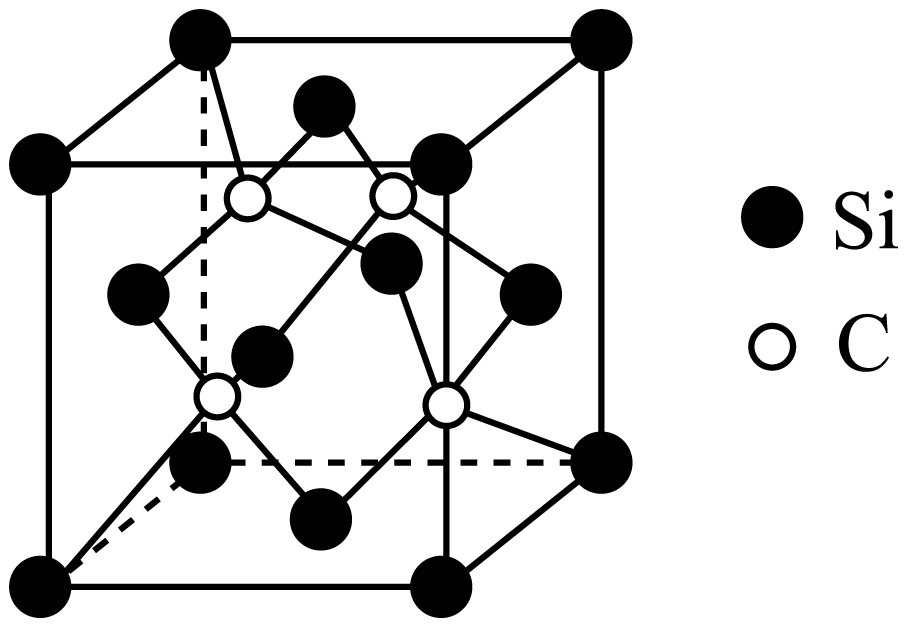
①碳化硅晶体中每个$\rm Si$原子周围等距且最近的$\rm C$原子数目为 。
②已知碳化硅的晶胞边长为$a$ $\rm nm$,阿伏加德罗常数为${{{N}}_{\text{A}}}$,碳化硅晶体的密度为 $\text{g}\cdot \text{c}{{\text{m}}^{-3}}$。
$\\rm 4$ ;$\\dfrac{160}{{{10}^{-21}}{{{a}}^{\\text{3}}}{{{N}}_{\\text{A}}}}$
"]]①由图可知,面心的$\rm Si$原子连接$\rm 2$个$\rm C$原子,面心的$\rm Si$原子为$\rm 2$个晶胞共有,则碳化硅晶体中每个$\rm Si$原子周围距离最近的$\rm C$原子数目为$\rm 4$;
②硅原子位于立方体的顶点和面心,个数为$\rm 8\times \dfrac{1}{8}\rm +6\times \dfrac{1}{2}\rm =4$,$\rm 4$个碳原子位于立方体的内部,晶胞质量为$\dfrac{\text{4}\times \text{(28+12)}}{{N}{}_{\text{A}}}\ \text g=\dfrac{\text{160}}{{N}{}_{\text{A}}}\ \rm g$,晶胞体积为$\rm (a\times 10^{-7})^{3}\;\rm cm^{3}$,碳化硅晶体密度$\rho=\dfrac{{m}}{{V}} =\dfrac{\dfrac{\text{160}}{{N}{}_{\text{A}}}\ \text{g}}{{a}\times \text{1}{{\text{0}}^{\text{-7}}}{{}^{\text{3}}}\ \text{c}{{{\text m}}^{\text{3}}}} =\dfrac{160}{{{10}^{-21}}{{{a}}^{\text{3}}}{{{N}}_{\text{A}}}}\ \rm g/cm^{3}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
