高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
$\text{C}{{\text{u}}^{2+}}$能作为中心离子形成多种配合物,一种$\text{C}{{\text{u}}^{2+}}$形成的配离子结构如下图
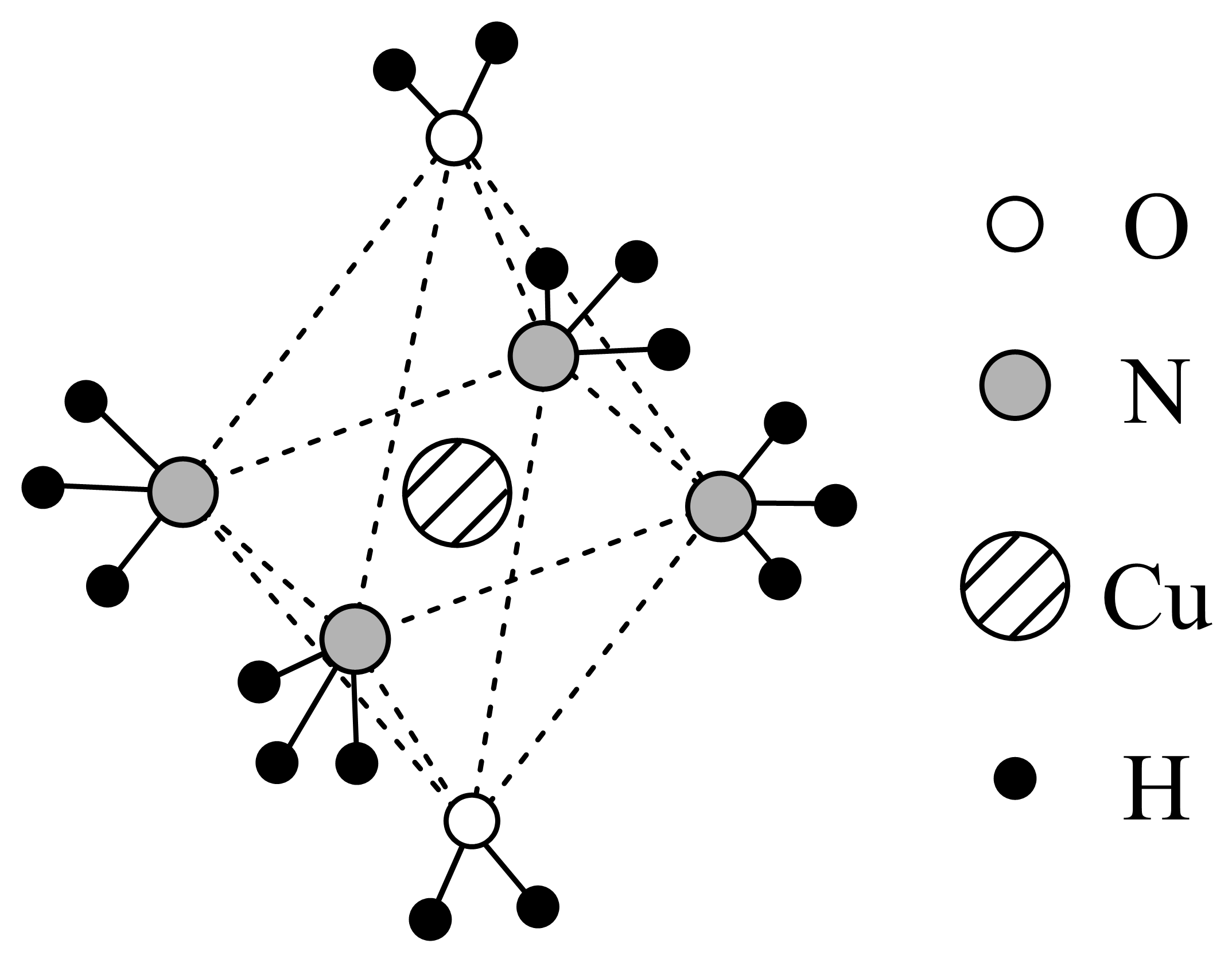
$\rm ($不定项$\rm )$下列说法正确的是 。
$\rm A$.该配离子结构为正八面体 $\rm B$.$\rm \text{C}{{\text{u}}^{2+}}$的配位数是$\rm 4$
$\rm C$.配离子中氮的价层电子对数和氧相同 $\rm D$.配离子中$\rm \text{H}-\text{O}-\text{H}$的键角大于$\rm {{\text{H}}_{2}}\text{O}$的$\rm \text{H}-\text{O}-\text{H}$键角。
$\\rm CD$
"]]$\rm A$.该配离子的中心离子为$\rm Cu^{2+}$,配体为$\rm 2$个$\rm H_{2}O$和$\rm 4$个$\rm NH_{3}$,配位键长度不完全相同,因此该配离子不是正八面体,$\rm A$错误;
$\rm B$.$\rm Cu^{2+}$的配位数为$\rm 6$,$\rm B$错误;
$\rm C$.$\rm NH_{3}$的中心原子为$\rm N$,价层电子对数为$\rm 3+\dfrac{5-3\times 1}{2}=4$,$\rm H_{2}O$的中心原子为$\rm O$,价层电子对数为$\rm 2+\dfrac{6-2\times 1}{2}=4$,价层电子对数相同,$\rm C$正确;
$\rm D$.配离子中$\rm H_{2}O$中$\rm O$原子一个孤电子对与$\rm Cu$形成配位键,即剩余孤电子对为$\rm 1$,而$\rm H_{2}O$中的$\rm O$原子孤电子对为$\rm 2$,孤电子对数越多对成键电子对斥力越大,键角就越小,配离子中$\text{H}-\text{O}-\text{H}$的键角大于${{\text{H}}_{2}}\text{O}$的$\text{H}-\text{O}-\text{H}$键角,$\rm D$正确;
该配离子的化学式为 ,形成该配离子的元素第一电离能从大到小顺序为 。
${{\\left[ \\text{Cu}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{4}}{{\\left( {{\\text{H}}_{2}}\\text{O} \\right)}_{2}} \\right]}^{2+}}$ ; $\\text{N}\\gt \\text{O}\\gt \\text{H}\\gt \\text{Cu}$
"]]该配离子的中心离子为$\rm Cu^{2+}$,配体有$\rm 2$个$\rm H_{2}O$和$\rm 4$个$\rm NH_{3}$,化学式为:${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{2}} \right]}^{2+}}$;
$\rm N$、$\rm O$同周期,$\rm N$原子$\rm 2p$能级半充满稳定,第一电离能大于$\rm O$,$\rm O$的第一电离能大于$\rm H$,$\rm Cu$是金属,第一电离能最小,因此第一电离能从大到小的顺序为:$\text{N}\gt \text{O}\gt \text{H}\gt \text{Cu}$;
加热时该配离子先失去的配体是 ,原因是 。
${{\\text{H}}_{2}}\\text{O}$ ; $\\rm O$的电负性强于$\\rm N$元素,${{\\text{H}}_{2}}\\text{O}$的孤电子对相对不易给出,${{\\text{H}}_{2}}\\text{O}$与$\\text{C}{{\\text{u}}^{2+}}$形成的配位键更弱,因此加热时更易失去
"]]$\rm O$的电负性强于$\rm N$元素,${{\text{H}}_{2}}\text{O}$的孤电子对相对不易给出,${{\text{H}}_{2}}\text{O}$与$\text{C}{{\text{u}}^{2+}}$形成的配位键更弱,因此加热时更易失去,所以加热时最先失去的配体是$\rm H_{2}O$。
高中 | 配合物理论题目答案及解析(完整版)
