高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
从褐铁矿型金$\rm -$银矿$\rm ($含$\rm Au$、$\rm Ag$、$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\text{Mn}{{\text{O}}_{2}}$、$\rm CuO$、$\text{Si}{{\text{O}}_{2}}$等$\rm )$中提取$\rm Au$、$\rm Ag$,并回收其它有价金属的一种工艺如下:
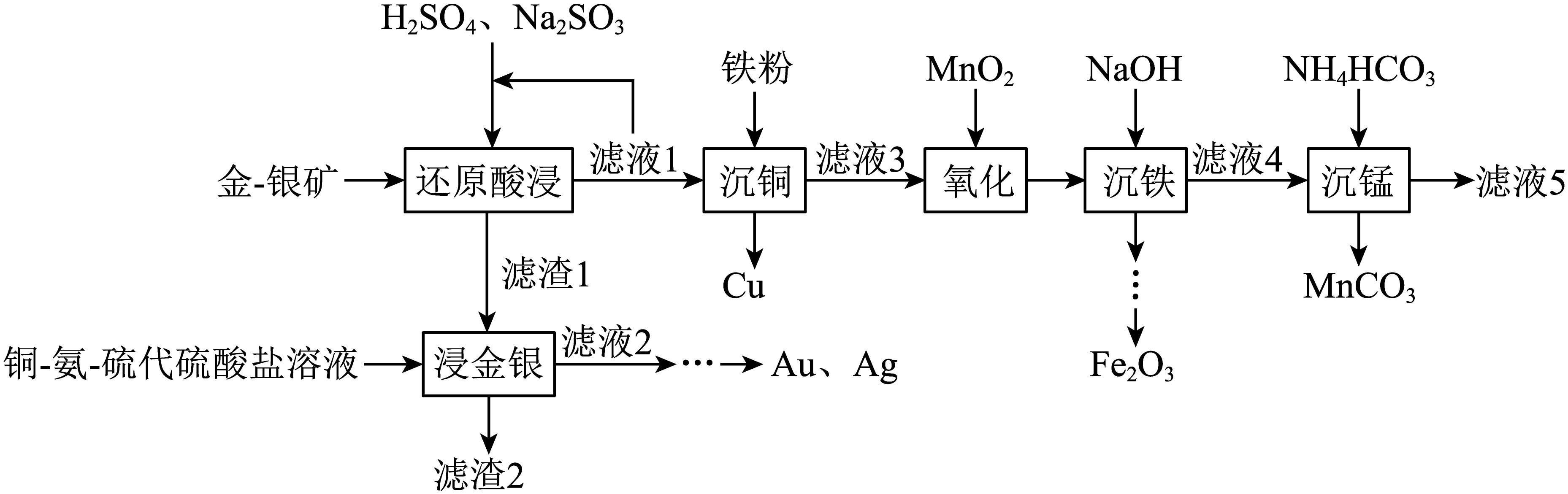
已知:①金$\rm -$银矿中$\rm Cu$、$\rm Mn$元素的含量分别为$\rm 0.19\%$、$\rm 2.35\%$。
②$\rm 25\;\rm ^\circ\rm C$时,$\text{Mn}{{\left( \text{OH} \right)}_{2}}$的${{{K}}_{\text{sp}}}$为$1.9\times {{10}^{-13}}$。
回答下列问题:
基态$\rm Cu$原子的价层电子排布式为 。
$3{{\\text{d}}^{10}}4{{\\text{s}}^{1}}$
"]]$\rm Cu$为$\rm 29$号元素,基态$\rm Cu$原子的核外电子排布属于洪物规则的特例,其价电子数为$\rm 11$,其价层电子排布式为$3{{\text{d}}^{10}}4{{\text{s}}^{1}}$。
“还原酸浸”时,$\text{Mn}{{\text{O}}_{2}}$反应的离子方程式为 。
$\\text{Mn}{{\\text{O}}_{2}}+\\text{SO}_{3}^{2-}+2{{\\text{H}}^{+}}=\\text{M}{{\\text{n}}^{2+}}+\\text{SO}_{4}^{2-}+{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]“还原酸浸”时,$\text{Mn}{{\text{O}}_{2}}$被亚硫酸钠还原为$\text{M}{{\text{n}}^{2+}}$,该反应的离子方程式为$\text{Mn}{{\text{O}}_{2}}+\text{SO}_{3}^{2-}+2{{\text{H}}^{+}}=\text{M}{{\text{n}}^{2+}}+\text{SO}_{4}^{2-}+{{\text{H}}_{\text{2}}}\text{O}$。
“浸金银”时,$\rm Au$溶解涉及的主要反应如下:
①$\text{Au}+5{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}={{\left[ \text{Au}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{2}} \right]}^{3-}}+{{\left[ \text{Cu}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{3}} \right]}^{5-}}+4\text{N}{{\text{H}}_{3}}$
②$4{{\left[ \text{Cu}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{3}} \right]}^{5-}}+16\text{N}{{\text{H}}_{3}}+{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=4{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}+4\text{O}{{\text{H}}^{-}}+12{{\text{S}}_{2}}\text{O}_{3}^{2-}$
上述过程中的催化剂为 。
${{\\left[ \\text{Cu}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{4}} \\right]}^{2+}}$
"]]“浸金银”时,$\rm Au$溶解涉及的主要反应如下:
①$\text{Au}+5{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}={{\left[ \text{Au}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{2}} \right]}^{3-}}+{{\left[ \text{Cu}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{3}} \right]}^{5-}}+4\text{N}{{\text{H}}_{3}}$
②$4{{\left[ \text{Cu}{{\left( {{\text{S}}_{2}}{{\text{O}}_{3}} \right)}_{3}} \right]}^{5-}}+16\text{N}{{\text{H}}_{3}}+{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=4{{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}+4\text{O}{{\text{H}}^{-}}+12{{\text{S}}_{2}}\text{O}_{3}^{2-}$
分析以上两反应可知,${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}$参与了反应①,但在反应②又重新生成,其质量和性质在反应前后没发生变化,因此,上述过程中的催化剂为${{\left[ \text{Cu}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{4}} \right]}^{2+}}$。
“沉铜”前,“滤液$\rm 1$”多次循环的目的为 。
大幅度降低硫酸和亚碳酸钠的消耗成本,同时减少废水产生量及处理成本,并通过持续去除杂质提高金银的富含度
"]]“还原酸浸”所得“滤液$\rm 1$”中含有一定浓度的未反应的硫酸和亚硫酸钠,多次循环利用“滤液$\rm 1$”对矿石进行“还原酸浸”可以充分利用其中的有效成分,大大减少了原料的浪费,从而有效降低成本;其次,持续地将杂质元素溶解并带出矿石体系,可以使矿石中的金银的相对品位得到提升,为后续提纯工序创造更好的条件;第三,还可以减少废水的排放量和处理成本;第四,可以回收更多的有价值的溶解成分。综上所述,“沉铜”前,“滤液$\rm 1$”多次循环的目的为:大幅度降低硫酸和亚碳酸钠的消耗成本,同时减少废水产生量及处理成本,并通过持续去除杂质提高金银的富含度。
根据“还原酸浸”“氧化”,推断$\text{F}{{\text{e}}^{3+}}、\text{C}{{\text{u}}^{2+}}、\text{Mn}{{\text{O}}_{2}}$的氧化性由强到弱的顺序为 。
$\\text{Mn}{{\\text{O}}_{2}}\\gt \\text{F}{{\\text{e}}^{3+}}\\gt \\text{C}{{\\text{u}}^{2+}}$
"]]“还原酸浸”时,$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$和$\rm CuO$可以被硫酸溶解转化为$\text{F}{{\text{e}}^{3+}}$和$\text{C}{{\text{u}}^{2+}}$,亚硫酸钠将$\text{F}{{\text{e}}^{3+}}$还原为$\text{F}{{\text{e}}^{2+}}$,而$\text{C}{{\text{u}}^{2+}}$并未被还原,因此,$\text{F}{{\text{e}}^{3+}}$的氧化性强于$\text{C}{{\text{u}}^{2+}}$;“氧化”时,$\text{F}{{\text{e}}^{2+}}$被$\text{Mn}{{\text{O}}_{2}}$氧化为$\text{F}{{\text{e}}^{3+}}$,因此,$\text{Mn}{{\text{O}}_{2}}$的氧化性强于$\text{F}{{\text{e}}^{3+}}$。综上所述,根据“还原酸浸”“氧化”,推断$\text{F}{{\text{e}}^{3+}}\text{C}{{\text{u}}^{2+}}\text{Mn}{{\text{O}}_{2}}$的氧化性由强到弱的顺序为$\text{Mn}{{\text{O}}_{2}}\gt \text{F}{{\text{e}}^{3+}}\gt \text{C}{{\text{u}}^{2+}}$。
$\rm 25\;\rm ^\circ\rm C$“沉铁”后,调节“滤液$\rm 4$”的$\rm pH$至$\rm 8.0$,无$\text{Mn}{{\left( \text{OH} \right)}_{2}}$析出,则${c}\left( \text{M}{{\text{n}}^{2+}} \right)\le $ $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
$\\rm 0.19$
"]]$\rm 25\;\rm ^\circ\rm C$“沉铁”后,调节“滤液$\rm 4$”的$\rm pH$至$\rm 8.0$,此时${c}\left( \text{O}{{\text{H}}^{-}} \right)={{10}^{-6}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,无$\text{Mn}{{\left( \text{OH} \right)}_{2}}$析出,根据$\text{Mn}{{\left( \text{OH} \right)}_{2}}$的${{{K}}_{\text{sp}}}$为$1.9\times {{10}^{-13}}$,则${c}\left( \text{M}{{\text{n}}^{2+}} \right)\le \dfrac{1.9\times {{10}^{-13}}}{{{({{10}^{-6}})}^{2}}}=0.19\ \mathrm{mol} \cdot \mathrm{L}^{-1}$。
一种锑锰$\left( \text{M}{{\text{n}}_{3}}\text{Sb} \right)$合金的立方晶胞结构如图。
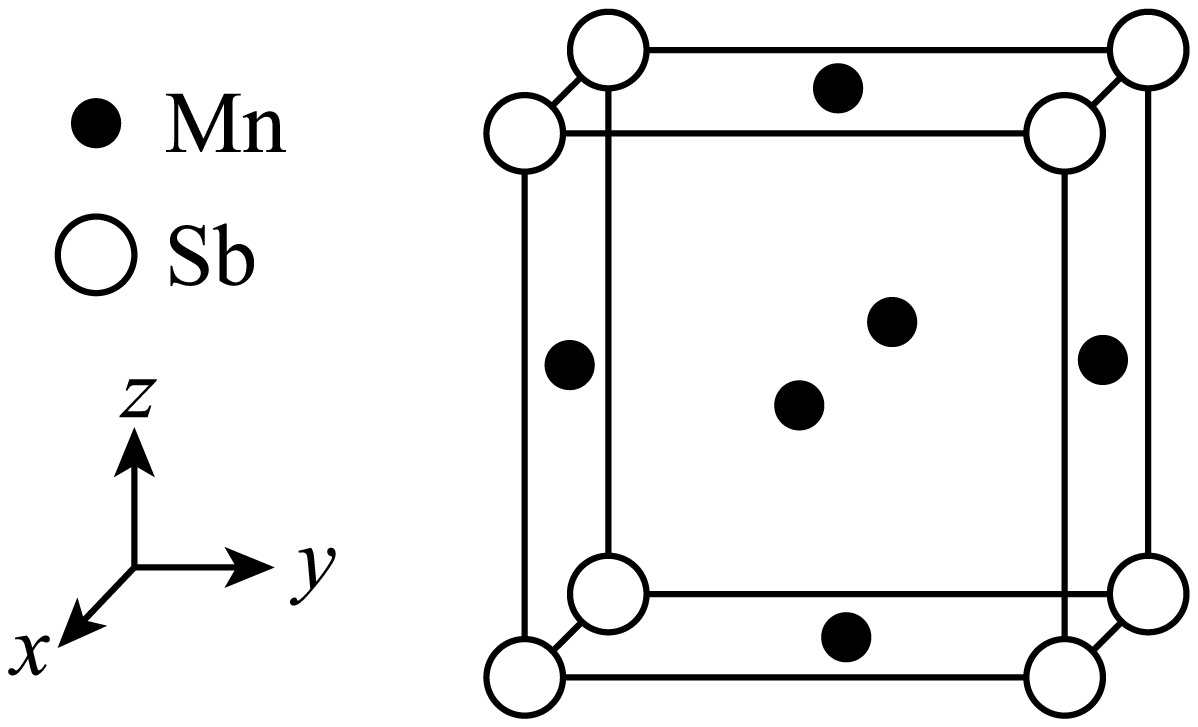
①该晶胞中,每个$\rm Sb$周围与它最近且相等距离的$\rm Mn$有 个。
②${{{N}}_{\text{A}}}$为阿伏加德罗常数的值,晶胞边长为$a\rm \ nm$,则晶体的密度为 $\text{g}\cdot \text{c}{{\text{m}}^{-\text{3}}}\rm ($列出计算式即可$\rm )$。
$\\rm 12$; $\\dfrac{122+55\\times 3}{{{N}_{\\text{A}}}\\times {{{a}}^{3}}\\times {{10}^{-21}}}$
"]]由晶胞结构可知,该晶胞为面心立方, $\rm Sb$位于晶胞的顶点,其与邻近的$\rm 3$个面的面心上的$\rm Mn$距离最近且距离相等,每个顶点参与形成$\rm 8$个晶胞,而每个面心参与形成$\rm 2$个晶胞,因此,该晶胞中,每个$\rm Sb$周围与它最近且相等距离的$\rm Mn$有$\dfrac{3\times 8}{2}=12$个。
②由晶胞结构和均摊法可知,该晶胞中平均占有$\rm 1$个$\rm Sb$和$\rm 3$个$\rm Mn$,因此,该晶胞的质量为$\dfrac{122+55\times 3}{{{N}_{\text{A}}}}\ \text{g}$,该晶胞的体积为${{({a\ \rm nm})}^{3}}={a}\times {{10}^{-21}}\ \text{c}{{\text{m}}^{3}}$,晶体的密度为$\dfrac{\left( 122+55\times 3 \right)\ \text{g}}{{{N}_{\text{A}}}\times {{{a}}^{3}}\times {{10}^{-21}}\ \text{c}{{\text{m}}^{3}}}=\dfrac{122+55\times 3}{{{N}_{\text{A}}}\times {{{a}}^{3}}\times {{10}^{-21}}}\ \text{g}\cdot \text{c}{{\text{m}}^{-\text{3}}}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
