高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
用于$\rm HMF($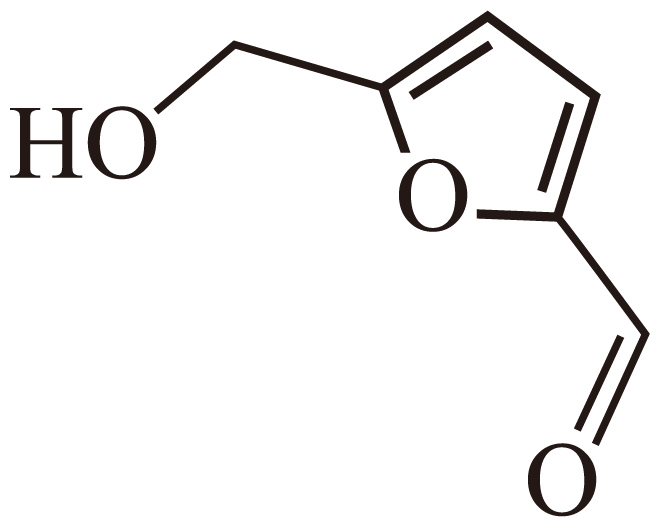 $\rm )$转化为$\rm FDCA($
$\rm )$转化为$\rm FDCA($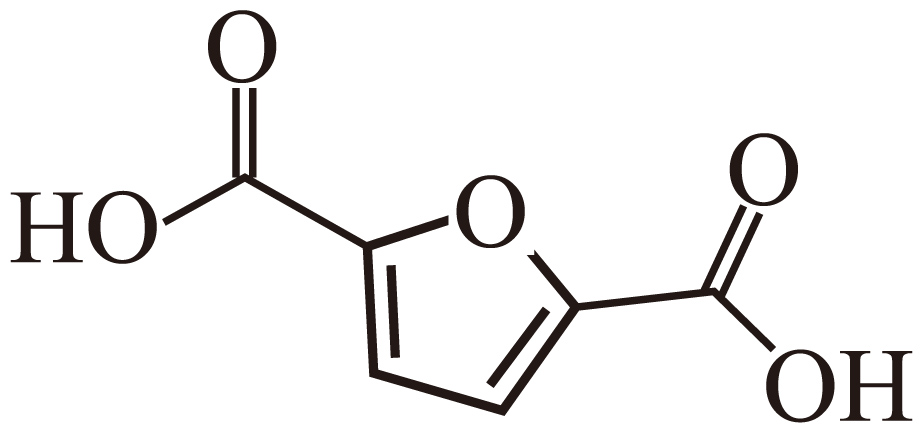 $\rm )$的液流燃料电池$\rm (LFFC)$的结构和原理示意图如下图所示。该系统采用了酸性$\rm -$碱性电解液的不对称设计,使用$1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ KOH}$作为$\rm M$极电解液,使用$2\;\rm \text{mol}\cdot {{\text{L}}^{-1}}{{\text{ H}}_{2}}\text{S}{{\text{O}}_{4}}$作为$\rm N$极电解液。下列说法正确的是$(\qquad)$
$\rm )$的液流燃料电池$\rm (LFFC)$的结构和原理示意图如下图所示。该系统采用了酸性$\rm -$碱性电解液的不对称设计,使用$1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ KOH}$作为$\rm M$极电解液,使用$2\;\rm \text{mol}\cdot {{\text{L}}^{-1}}{{\text{ H}}_{2}}\text{S}{{\text{O}}_{4}}$作为$\rm N$极电解液。下列说法正确的是$(\qquad)$
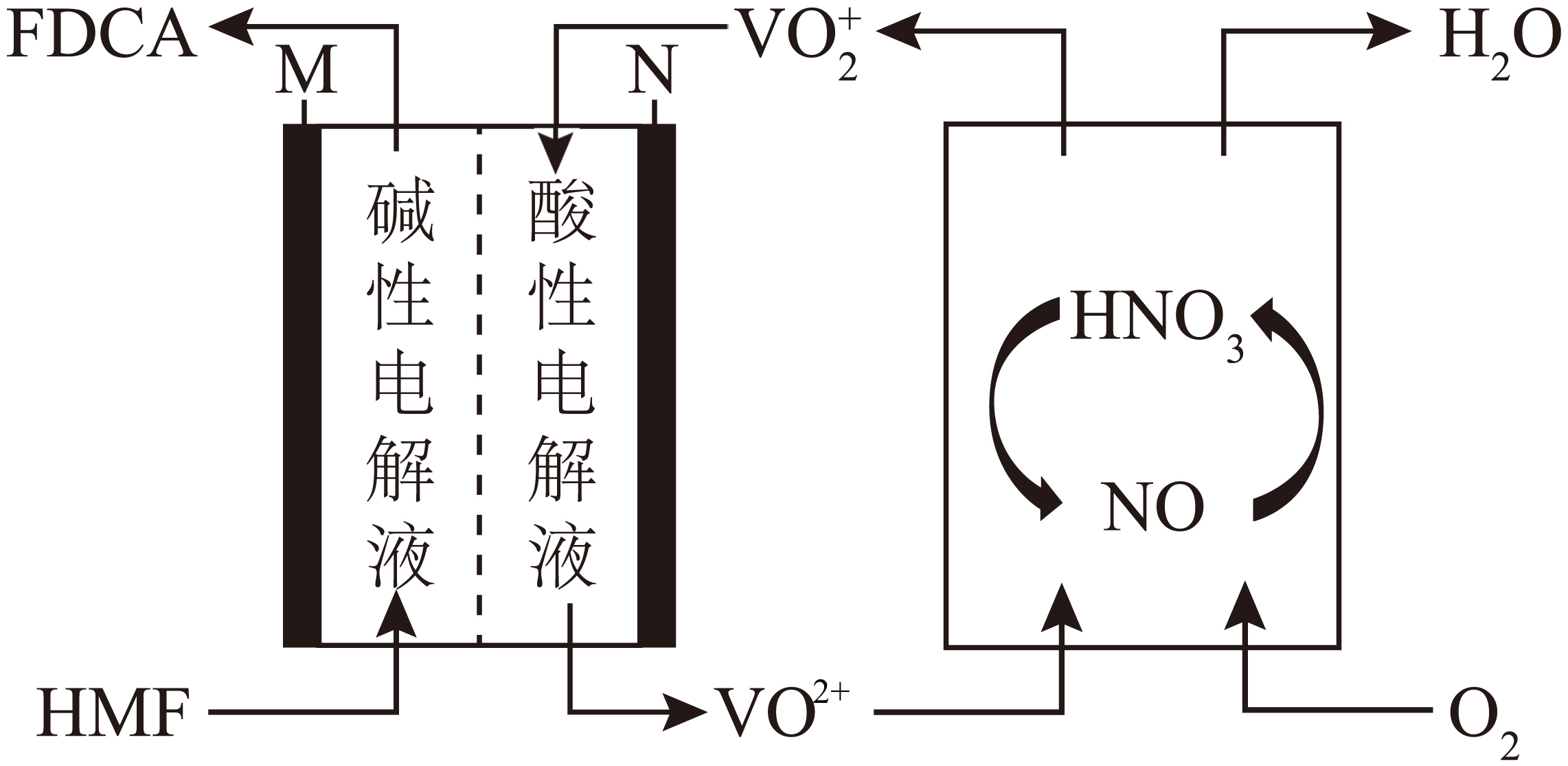
电子由$\\rm N$极通过外电路转移到$\\rm M$极
","$\\rm M$极的电极反应为$\\rm \\text{HMF}+6\\text{O}{{\\text{H}}^{-}}+6{{\\text{e}}^{-}}= 4{{\\text{H}}_{2}}\\text{O}+\\text{FDCA}$
","理论上,随反应进行需要及时添加$\\rm \\text{HN}{{\\text{O}}_{3}}$
","理论上,当消耗$\\rm 1.5\\;\\rm \\text{mol }{{\\text{O}}_{2}}$时生成$\\rm 1\\text{ mol FDCA}$
"]$\rm N$极$\rm V$化合价$\rm +5→+4$,得电子,则$\rm N$极为正极,电极反应式为$\rm VO_{2}^{+}+{{\text{e}}^{-}}+2{{\text{H}}^{+}}=V{{O}^{2+}}+{{\text{H}}_{2}}\text{O}$,故$\rm M$极为负极,电极反应式为:$\rm \text{HMF}+6\text{O}{{\text{H}}^{-}}-6{{\text{e}}^{-}}=4{{\text{H}}_{2}}\text{O}+\text{FDCA}$。生成的$\rm VO^{2+}$在$\rm NO$、$\rm HNO_{3}$的催化下与氧气反应生成$\rm VO_{2}^{+}$和$\rm H_{2}O$。
$\rm A$.据分析,$\rm N$极为正极,$\rm M$极为负极,电子由$\rm M$极通过外电路转移到$\rm N$极,故$\rm A$错误;
$\rm B$.据分析,$\rm M$极的电极反应为$\rm \text{HMF}+6\text{O}{{\text{H}}^{-}}-6{{\text{e}}^{-}}=4{{\text{H}}_{2}}\text{O}+\text{FDCA}$,故$\rm B$错误;
$\rm C$.由图示可知,$\rm \text{HN}{{\text{O}}_{3}}$通过通入氧气再生,循环利用,无需添加,故$\rm C$错误;
$\rm D$.根据电子守恒,列出关系式:$\rm 1.5\;\rm \text{mol }{{\text{O}}_{2}}\sim 6\;\rm \text{mol }{{\text{e}}^{-}}\sim 1\text{ mol FDCA}$,故$\rm D$正确。
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
