高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
$\text{1T-Mo}{{\text{S}}_{\text{2}}}\rm /$石墨烯电极材料可在光照条件下产生电子$\rm ({{\text{e}}^{-}}\rm )$和空穴$\rm ({{\text{h}}^{+}}\rm )$,其制氧效果优越,原理如图所示。下列叙述正确的是$(\quad\ \ \ \ )$
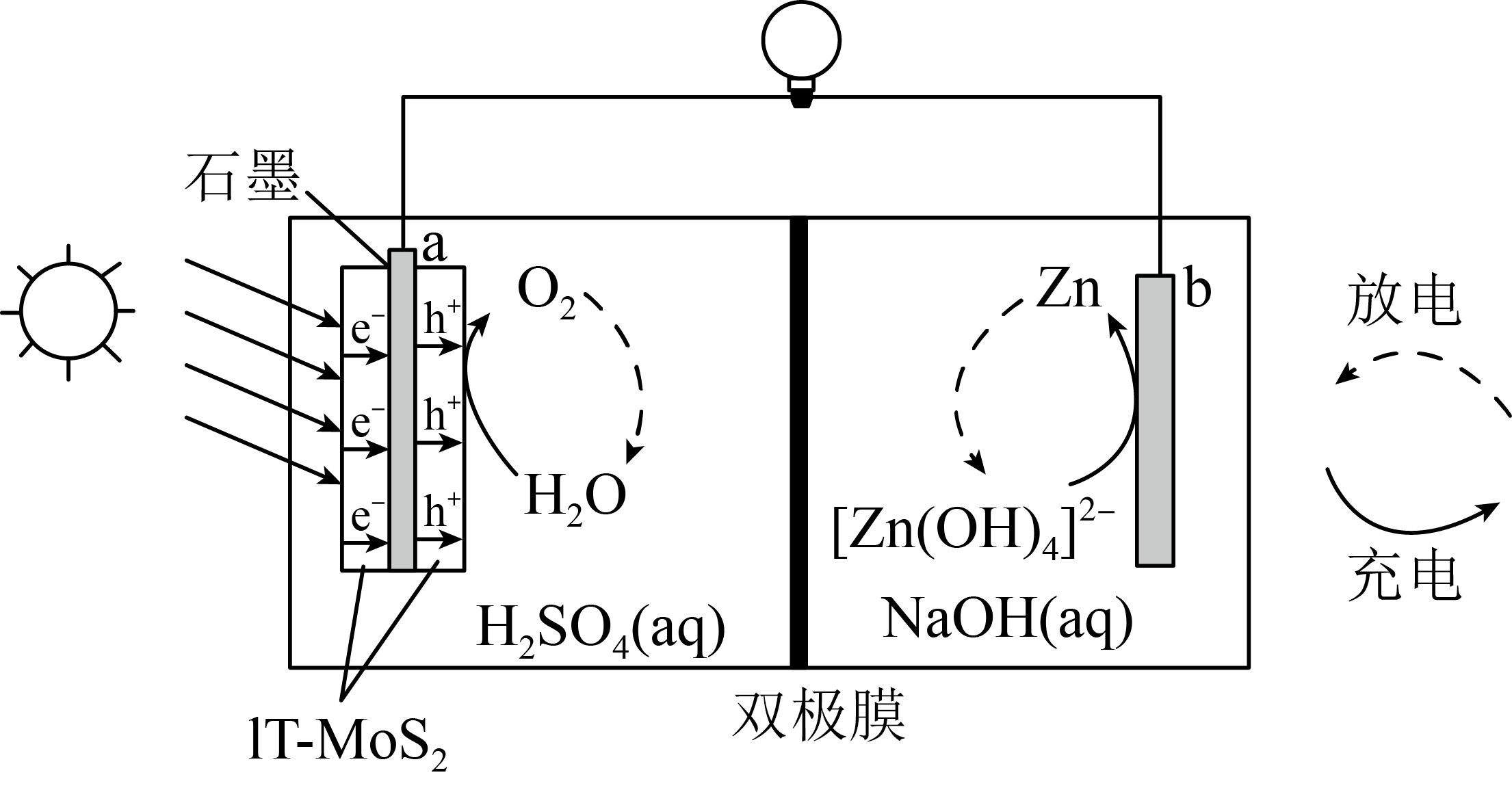
放电时,电子流向:$\\rm b→$离子交换膜$\\rm →a$
","放电时,每消耗$\\rm 0.1$ $\\rm mol\\ {{\\text{O}}_{2}}$,负极区电解质溶液的质量增加$\\rm 13$ $\\rm g$
","充电时,电势高低:$\\rm a\\lt b$
","充电时,电池总反应:$2{{\\left[ \\text{Zn}{{(\\text{OH})}_{4}} \\right]}^{2-}}=2\\text{Zn}+{{\\text{O}}_{2}}\\uparrow +4\\text{O}{{\\text{H}}^{-}}+2{{\\text{H}}_{2}}\\text{O}$
"]放电时,该装置为原电池,$\rm Zn$为负极,发生氧化反应$\text{Zn}-\text{2}{{\text{e}}^{-}}+4\text{O}{{\text{H}}^{-}}={{\left[ \text{Zn(OH}{{\text{)}}_{4}} \right]}^{2-}}$;$\text{1T-Mo}{{\text{S}}_{\text{2}}}$为正极,发生还原反应${{\text{O}}_{\text{2}}}+4{{\text{e}}^{-}}+4{{\text{H}}^{+}}=2{{\text{H}}_{\text{2}}}\text{O}$;充电时,该装置为电解池,${{\left[ \text{Zn}(\text{OH})_{4}^{{}} \right]}^{2-}}$在阴极$\rm (b$极$\rm )$得电子生成$\rm Zn$,$\rm H_{2}O$在阳极$\rm (a$极$\rm )$失电子生成${{\text{O}}_{2}}$。
$\rm A$.电子只在导线中移动,不进入电解质溶液,电子流向:$\rm b→$导线$\rm →a$,故$\rm A$错误;
$\rm B$.放电时,负极区电解质溶液增加的质量为失电子的锌和离子交换膜电离出来的$\text{O}{{\text{H}}^{-}}$的质量和,根据电极反应式可知每消耗$\rm 0.1$ $\rm mol$ ${{\text{O}}_{2}}$,转移$\rm 0.4$ $\rm mol$电子,有$\rm 0.2$ $\rm mol$ $\rm Zn$失电子进入溶液,$\rm 0.2$ $\rm mol$ $\text{O}{{\text{H}}^{-}}$由双极膜进入负极区,则质量增加$\rm (0.2\times 65+0.4\times 17)$ $\rm g=19.8$ $\rm g$,$\rm B$错误;
$\rm C$.阳极电势高于阴极电势,由思路分析可知,充电时$a$电极电势高于$b$电极电势,$\rm C$错误;
$\rm D$.充电时,阳极反应为$2{{\text{H}}_{\text{2}}}\text{O}-4{{\text{e}}^{-}}={{\text{O}}_{2}}\uparrow +4{{\text{H}}^{+}}$,阴极反应为$Z\text{n}\left( \text{OH} \right)_{4}^{2-}+2{{\text{e}}^{-}}\text{=Zn}+4\text{O}{{\text{H}}^{-}}$,总反应为$2{{\left[ \text{Zn}{{\left( \text{OH} \right)}_{4}} \right]}^{2-}}=2\text{Zn}+{{\text{O}}_{2}}\uparrow +4\text{O}{{\text{H}}^{-}}+2{{\text{H}}_{2}}\text{O}$,$\rm D$正确;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
