高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
用如图所示的新型电池可以处理含$\rm C{{N}^{-}}$的碱性废水,同时还可以淡化海水$\rm ($主要成分为$\rm NaCl$,还含有$\rm N{{a}_{2}}S{{O}_{4}}$等杂质$\rm )$。下列说法错误的是$\rm (\qquad)$
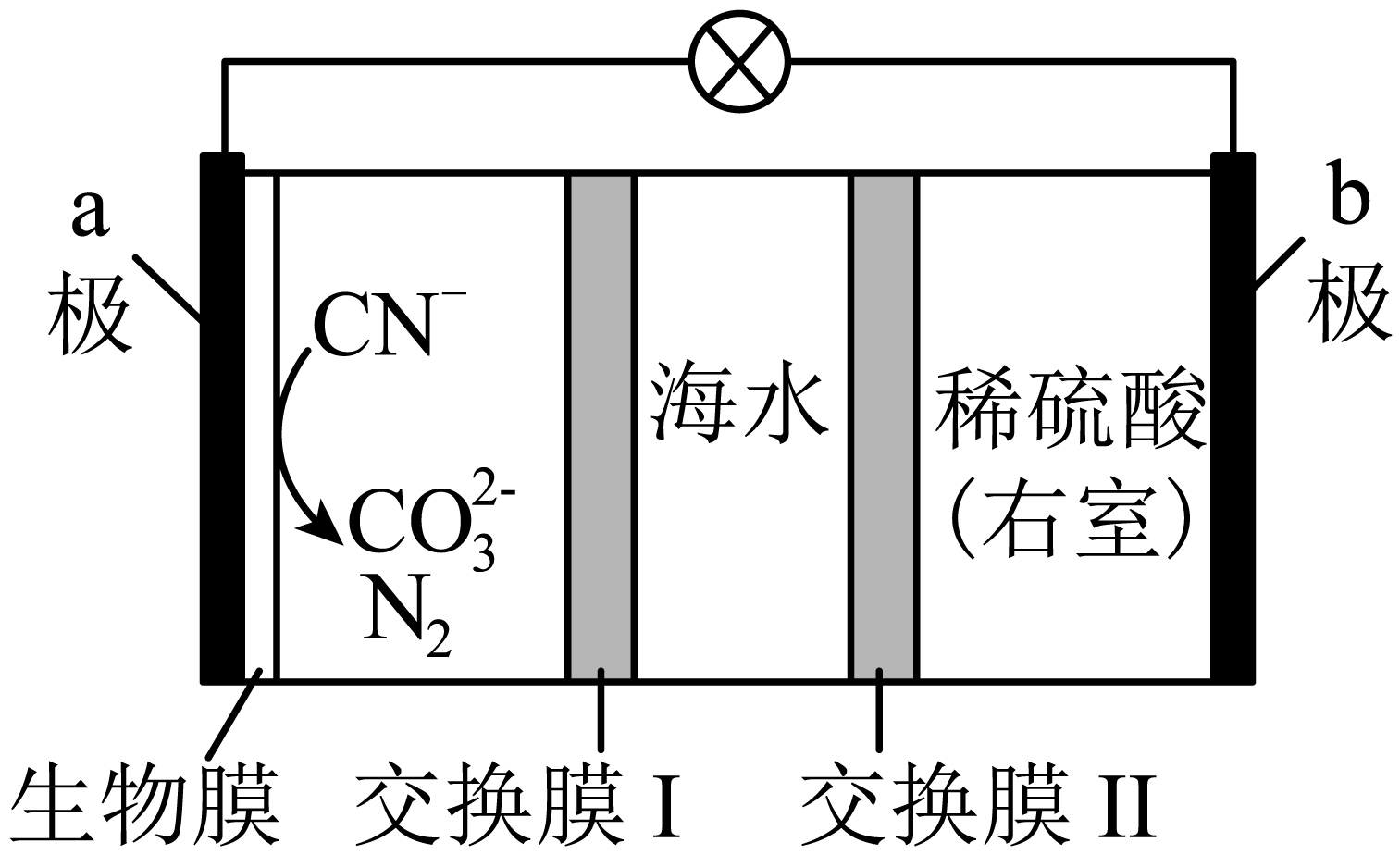
交换膜Ⅰ为阴离子交换膜
","电池工作一段时间后,右室溶液的$\\rm pH$增大
","$\\rm a$极电极反应式:$\\rm 2C{{N}^{-}}+12O{{H}^{-}}-10{{e}^{-}} = 2CO_{3}^{2-}+{{N}_{2}}\\uparrow +6{{H}_{2}}O$
","若将含有$\\rm 26\\ g\\ C{{N}^{-}}$的废水完全处理,可除去$\\rm NaCl$的质量为$\\rm 292.5\\ g$
"]如图所示的新型电池可以处理含$\rm C{{N}^{-}}$的碱性废水,在$\rm a$极,$\rm C{{N}^{-}}$失去电子,被氧化为$\rm {{N}_{2}}$和$\rm CO_{3}^{2-}$,为负极,电极反应式为$\rm 2C{{N}^{-}}+12O{{H}^{-}}-10{{e}^{-}} = 2CO_{3}^{2-}+{{N}_{2}}\uparrow +6{{H}_{2}}O$,则$\rm b$极为正极,$\rm {{H}^{+}}$得电子被还原为$\rm {{H}_{2}}$,电极反应式为$\rm 2{{H}^{+}}+2{{e}^{-}} = {{H}_{2}}\uparrow $,海水中的阴离子通过交换膜Ⅰ向左移动,阳离子通过交换膜Ⅱ向右移动,据此回答。
$\rm A$.$\rm a$电极失去电子,附近负电荷减少,为了淡化海水,阴离子通过交换膜Ⅰ向左移动,$\rm A$正确。
$\rm B$.由分析可知,$\rm b$为正极,电极反应式为$\rm 2{{H}^{+}}+2{{e}^{-}} = {{H}_{2}}\uparrow $,则消耗氢离子,$\rm pH$增大,$\rm B$正确。
$\rm C$.由分析可知,$\rm a$极电极反应式:$\rm 2C{{N}^{-}}+12O{{H}^{-}}-10{{e}^{-}}=2CO_{3}^{2-}+{{N}_{2}}\uparrow +6{{H}_{2}}O$,$\rm C$正确。
$\rm D$.$\rm 26\ g\ C{{N}^{-}}$的物质的量为$\rm 1\ mol$,根据选项$\rm A$分析可知,消耗$\rm 1\ mol\ C{{N}^{-}}$时转移$\rm 5 \ {mol}$电子,根据电荷守恒可知,可同时处理$\rm 5\ mol\ NaCl$,其质量为$\rm 292.5\ g$,但是海水中还含有$\rm SO_{4}^{2-}$等杂质离子,故除去$\rm NaCl$的质量小于$\rm 292.5\ g$,$\rm D$错误。
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
