高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
二甲醚$\rm (C{{H}_{3}}OC{{H}_{3}})$在制药、燃料、农药等化学工业中有许多独特的用途,同时其能作为可再生的清洁能源。回答下列问题:
已知:反应Ⅰ.${\rm 2CO(g)+4{{H}_{2}}(g)\rightleftharpoons 2C{{H}_{3}}OH(g)}\quad\Delta {{H}_{1}}=-a\ \rm kJ\cdot mo{{l}^{-1}}$。
反应Ⅱ.${\rm 3CO(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+C{{O}_{2}}(g)}\quad\Delta {{H}_{2}}=-b\ \rm kJ\cdot mo{{l}^{-1}}$。
反应Ⅲ.${\rm CO(g)+{{H}_{2}}O(g)\rightleftharpoons C{{O}_{2}}(g)+{{H}_{2}}(g)}\quad\Delta{{H}_{3}}=-c\ \rm kJ\cdot mo{{l}^{-1}}$$(a$、$ b$、$c$均为正实数$\rm )$。
反应Ⅳ.${\rm 2C{{H}_{3}}OH(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{4}}=$ $\rm \ kJ\cdot mo{{l}^{-1}}$。
$ a+c-b$
"]]根据盖斯定律,反应Ⅱ$\rm -$反应Ⅰ$\rm -$反应Ⅲ可得${\rm 2C{{H}_{3}}OH(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+{{H}_{2}}O(g)}\quad \Delta{{H}_{4}}=\Delta {{H}_{2}}- \Delta{{H}_{1}}- \Delta{{H}_{3}}=(a+c-b)\ \rm kJ\cdot mo{{l}^{-1}}$。
向恒容反应器中充入$\rm 8\ mol\ C{{H}_{3}}OH$,控制条件发生反应:${\rm 2C{{H}_{3}}OH(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+{{H}_{2}}O(g) }\quad\Delta {{H}_{4}}$,平衡常数${{K}_{4}}$随温度和压强的变化如表所示:
温度${{K}_{4}}$ 压强$p$ | $\rm 2\ MPa$ | $\rm 3\ MPa$ | $\rm 4\ MPa$ |
| $\rm 200\ ^\circ \text{C}$ | $x$ | $y$ | $\rm 10$ |
| $\rm 300^\circ C$ | $z$ | $\rm 0.25$ |
①$ x$ $\rm ($填“$\rm \gt $”“$\rm =$”或“$\rm \lt $”,下同$)y$,$\Delta{{H}_{4}}$ $\rm 0$。
②向体积为$\rm 2\ L$、温度为$\rm 300\ ^\circ \text{C}$的恒温恒容反应器中充入$\rm 8\ mol\ C{{H}_{3}}OH$,反应达平衡时$\rm C{{H}_{3}}OH(g)$的转化率为 。
③提高二甲醚的平衡产率,可以采取的措施有 $\rm ($写两点$\rm )$。
$\\rm =$;$\\rm \\lt $;$\\rm 50\\%$;适当降低温度、不断地分离出水蒸气
"]]①该反应在恒容反应器中进行,由反应$\rm 2C{{H}_{3}}OH(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+{{H}_{2}}O(g)$可知,压强变化不会影响平衡状态,则$x=y=10$;压强均为$\rm 3\ MPa$时,平衡常数${{K}_{4}}$随温度升高而变小,说明反应逆向移动,因此该反应为放热反应,即$\Delta{{H}_{4}}\lt 0$。
②根据三段式:$\rm \begin{matrix} {} \\ 初始\rm (mol/L) \\ 转化\rm (mol/L) \\ 平衡\rm (mol/L) \\ \end{matrix}\begin{matrix} \rm 2C{{H}_{3}}OH(g) \\ 4 \\ a \\ 4-a \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \rm C{{H}_{3}}OC{{H}_{3}}(g) \\ 0 \\ 0.5a \\ 0.5a \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \rm {{H}_{2}}O(g) \\ 0 \\ 0.5\ g \\ 0.5a \\ \end{matrix}$,则$0.25=\dfrac{0.5a\times 0.5a}{{{(4-a)}^{2}}}$,解得$a=2$,$\rm C{{H}_{3}}OH(g)$的转化率$\rm =\dfrac{2\times 2\ mol}{8\ mol}\times 100\% =50\%$。
③提高二甲醚的平衡产率,则要使反应正向移动,该反应为放热反应,则适当降低温度或者不断地分离出水蒸气均可到达目标。
另一种合成二甲醚的方法反应原理为$\rm 3CO(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+C{{O}_{2}}(g)$,反应速率与物质浓度的关系为${{v}_{(正)}}={{k}_{(正)}}{{c}^{x}}{\rm (CO)}\cdot {{c}^{y}}({{\rm H}_{2}})$,${{v}_{(逆)}}={{k}_{(逆)}}c{\rm (C{{H}_{3}}OC{{H}_{3}})}\cdot c{\rm (C{{O}_{2}})}$[${{k}_{(正)}}$、${{k}_{(逆)}}$是只与温度有关的常数]。在$\rm 300\ ^\circ \text{C}$时测得的相关数据如下表所示:
| 实验编号 | 初始浓度 | 生成$\rm C{{H}_{3}}OC{{H}_{3}}$的初始速率$\rm /(mol\cdot {{L}^{-1}}\cdot {{s}^{-1}})$ | |
| $c{\rm (CO)}/\rm (mol\cdot L)$ | $c{\rm ({{H}_{2}})}/\rm (mol\cdot {{L}^{-1}})$ | ||
| $\rm 1$ | $\rm 2.00\times {{10}^{-3}}$ | $\rm 2.00\times {{10}^{-3}}$ | $\rm 3.2\times {{10}^{-3}}$ |
| $\rm 2$ | $\rm 1.00\times {{10}^{-3}}$ | $\rm 2.00\times {{10}^{-3}}$ | |
| $\rm 3$ | $\rm 2.00\times {{10}^{-3}}$ | $\rm 3.00\times {{10}^{-3}}$ | $\rm 4.8 \times 10^{-3}$ |
①$x=$ 。
②随着温度降低,${{k}_{(正)}}$、${{k}_{(逆)}}$ $\rm ($填字母$\rm )$。
$\rm A$.都增大
$\rm B$.都减小
$\rm C$.${{k}_{(正)}}$增大,${{k}_{(逆)}}$减小
$\rm D$.${{k}_{(正)}}$减小,${{k}_{(逆)}}$增大
③其他条件相同,反应达平衡时二甲醚的产率与温度的关系如图$\rm 1$所示。升高温度后,${{k}_{(正)}}$、${{k}_{(逆)}}$变化值较大的是 。
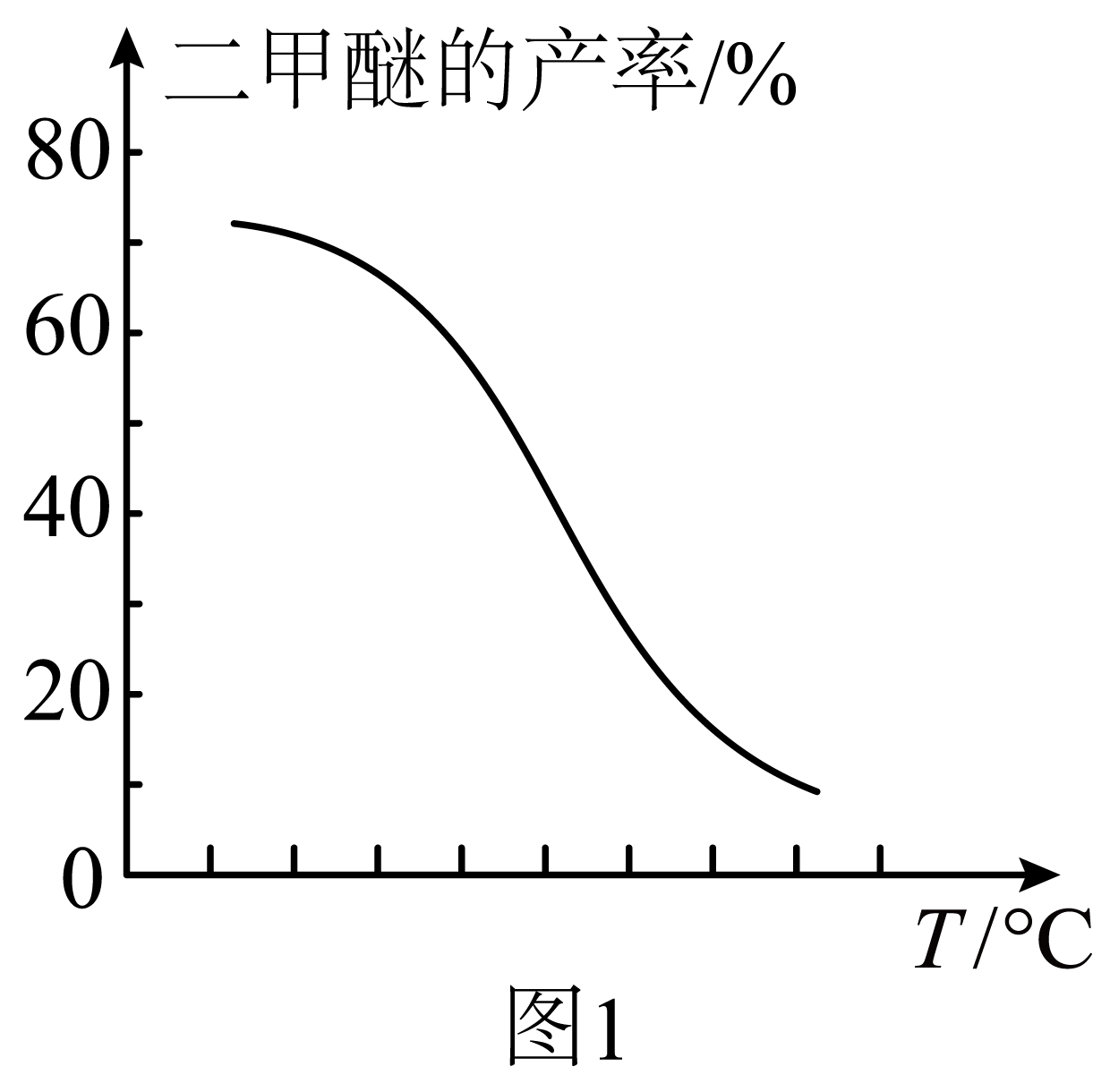
$\\rm 2$;$\\rm B$;${{k}_{(逆)}}$
"]]①根据$ {{v}_{(正)}}={{k}_{(正)}}{{c}^{x}}{\rm ( CO)}\cdot {{c}^{y}}({{\rm H}_{2}})$,温度不变,则${{k}_{(正)}}$不变,由$\rm 300\ ^\circ \text{C}$时测得的相关数据$\rm 1$、$\rm 2$代入有$\rm \begin{array}{*{35}{l}} 3.2\times {{10}^{-3}}={{k}_{(正)}}{{(2.00\times {{10}^{-3}})}^{x}}\cdot {{(2.00\times {{10}^{-3}})}^{y}} \\ 0.8\times {{10}^{-3}}={{k}_{(正)}}{{( 1.00\times {{10}^{-3}})}^{x}}\cdot {{(2.00\times {{10}^{-3}})}^{y}} \\ \end{array}$,可计算$ x=2$。
②根据${\rm 3CO(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OC{{H}_{3}}(g)+C{{O}_{2}}(g)}\quad\Delta {{H}_{2}}=-b\ \rm kJ\cdot mo{{l}^{-1}}$,可知该反应为放热反应,随着温度降低,平衡正向移动,但${{k}_{(正)}}$、${{k}_{(逆)}}$是只与温度有关的常数,则温度降低,${{k}_{(正)}}$、${{k}_{(逆)}}$都减小。
③由于该反应为放热反应,升高温度后,平衡逆向移动,即升高温度,${{k}_{\left(逆 \right)}}$增大得更多些。
某二甲醚熔融碳酸盐燃料电池如图$\rm 2$所示,该电池具有发电效率高、成本低等优点。
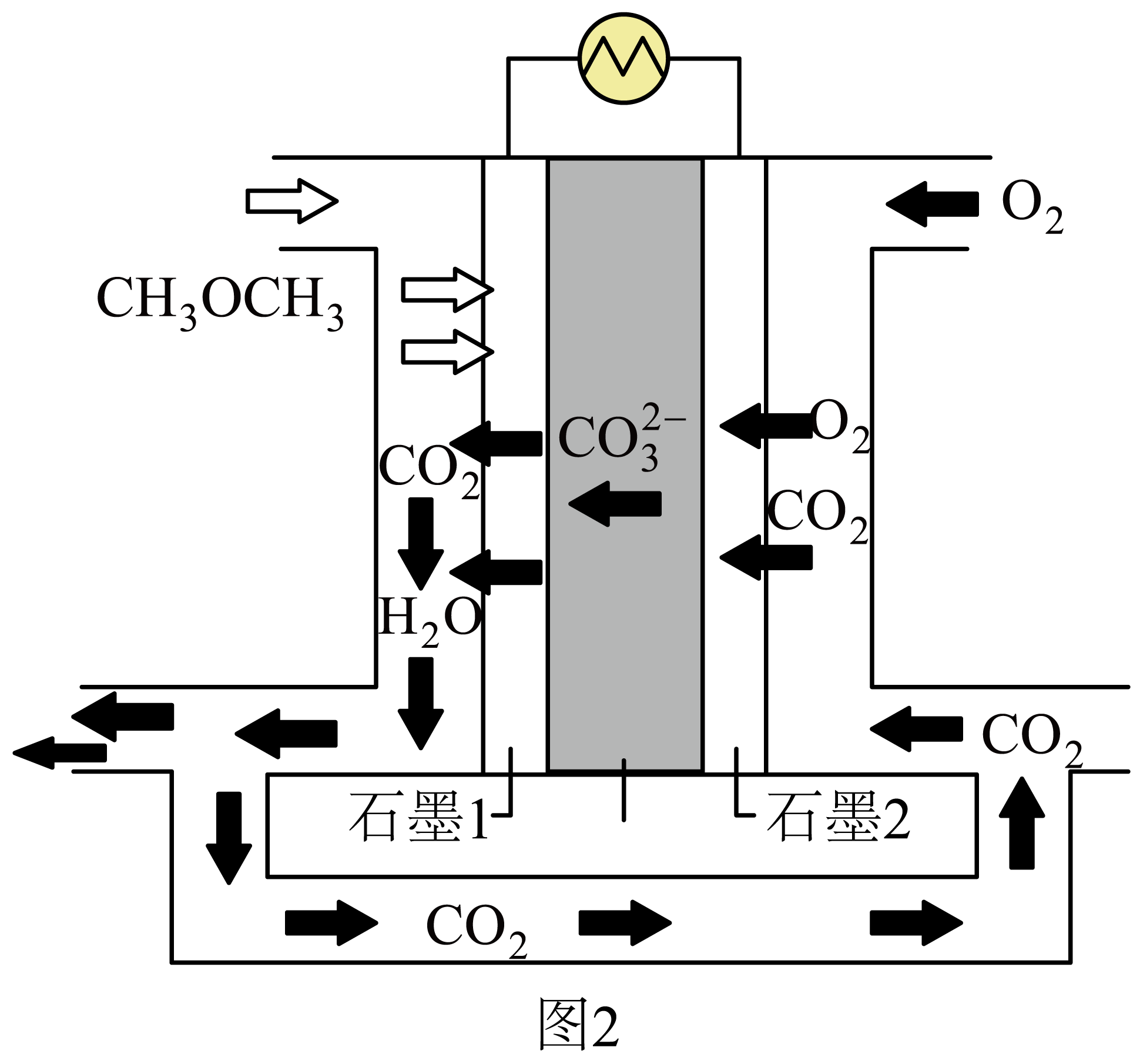
①石墨$\rm 1$极发生的电极反应式为 。
②每消耗$\rm 1\ mol\ C{{H}_{3}}OC{{H}_{3}}$,转移至负极的$\rm CO_{3}^{2-}$的物质的量为 $\rm \ mol$。
$\\rm C{{H}_{3}}OC{{H}_{3}}+6CO_{3}^{2-}-12{{e}^{-}} = 8C{{O}_{2}}\\uparrow +3{{H}_{2}}O$;$\\rm 6$
"]]①由图示可知,电池工作时,二甲醚失电子参与负极反应,氧气得电子参与正极反应,则石墨$\rm 1$电极反应式为$\rm C{{H}_{3}}OC{{H}_{3}}+6CO_{3}^{2-}-12{{e}^{-}} = 8C{{O}_{2}}\uparrow +3{{H}_{2}}O$。
②根据石墨$\rm 1$电极反应式:$\rm C{{H}_{3}}OC{{H}_{3}}+6CO_{3}^{2-}-12{{e}^{-}} = 8C{{O}_{2}}\uparrow +3{{H}_{2}}O$,则每消耗$\rm 1\ mol\ C{{H}_{3}}OC{{H}_{3}}$,转移至负极的$\rm CO_{3}^{2-}$的物质的量为$\rm 6\ mol$。
高中 | 盖斯定律题目答案及解析(完整版)
