高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
为理解离子化合物溶解过程的能量变化,可设想$\text{NaCl}$固体溶于水的过程分两步实现,示意图如下。
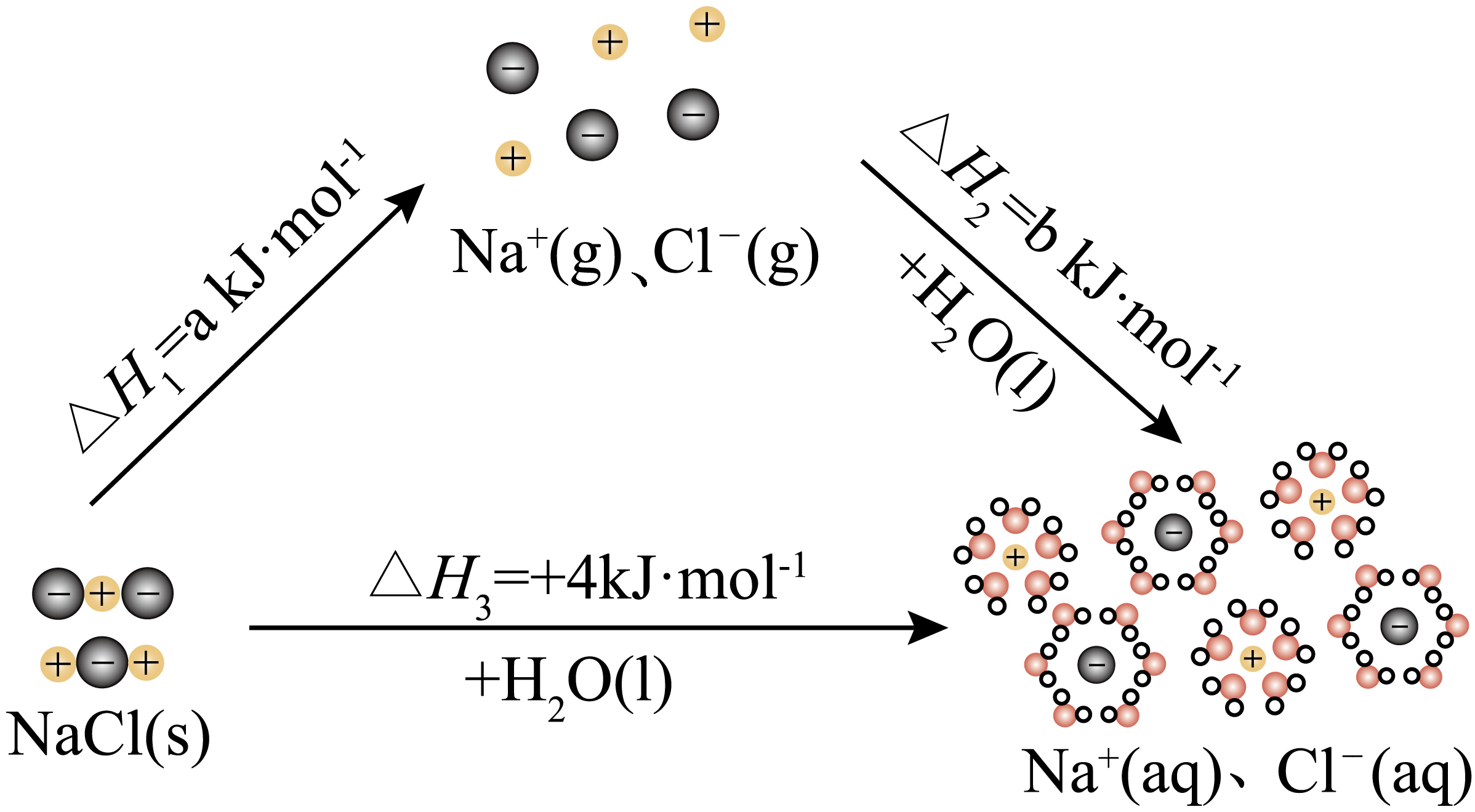
下列说法不正确的是$(\quad\ \ \ \ )$
$\\text{NaCl}$固体溶解是吸热过程
","根据盖斯定律可知:$a+b=4$
","根据各微粒的状态,可判断$a\\gt 0$,$b\\gt \\text{0}$
","溶解过程的能量变化,与$\\text{NaCl}$固体和$\\text{NaCl}$溶液中微粒间作用力的强弱有关
"]由图可知,$\text{NaCl}$固体溶于水的过程分两步实现,第一步为$\rm NaCl$固体变为$\rm Na^{+}$和$\rm Cl^{-}$,此过程离子键发生断裂,为吸热过程;第二步为$\rm Na^{+}$和$\rm Cl^{-}$与水结合形成水合钠离子和水合氯离子的过程,此过程为成键过程,为放热过程。
$\rm A$.由图可知,$\text{NaCl}$固体溶解过程的焓变为$\Delta {{H}_{3}}=+4\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,为吸热过程,$\rm A$正确;
$\rm B$.由图可知,$\text{NaCl}$固体溶于水的过程分两步实现,由盖斯定律可知$\Delta {{H}_{1}}=\Delta {{H}_{2}}+\Delta {{H}_{3}}$,即$a+b=4$,$\rm B$正确;
$\rm C$.由分析可知,第一步为$\rm NaCl$固体变为$\rm Na^{+}$和$\rm Cl^{-}$,此过程离子键发生断裂,为吸热过程,$a\gt 0$;第二步为$\rm Na^{+}$和$\rm Cl^{-}$与水结合形成水合钠离子和水合氯离子的过程,此过程为成键过程,为放热过程,$b\lt 0$,$\rm C$错误;
$\rm D$.由分析可知,溶解过程的能量变化,却决于$\text{NaCl}$固体断键吸收的热量及$\rm Na^{+}$和$\rm Cl^{-}$水合过程放出的热量有关,即与$\text{NaCl}$固体和$\text{NaCl}$溶液中微粒间作用力的强弱有关,$\rm D$正确;
故选:$\rm C$
高中 | 盖斯定律题目答案及解析(完整版)
