高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
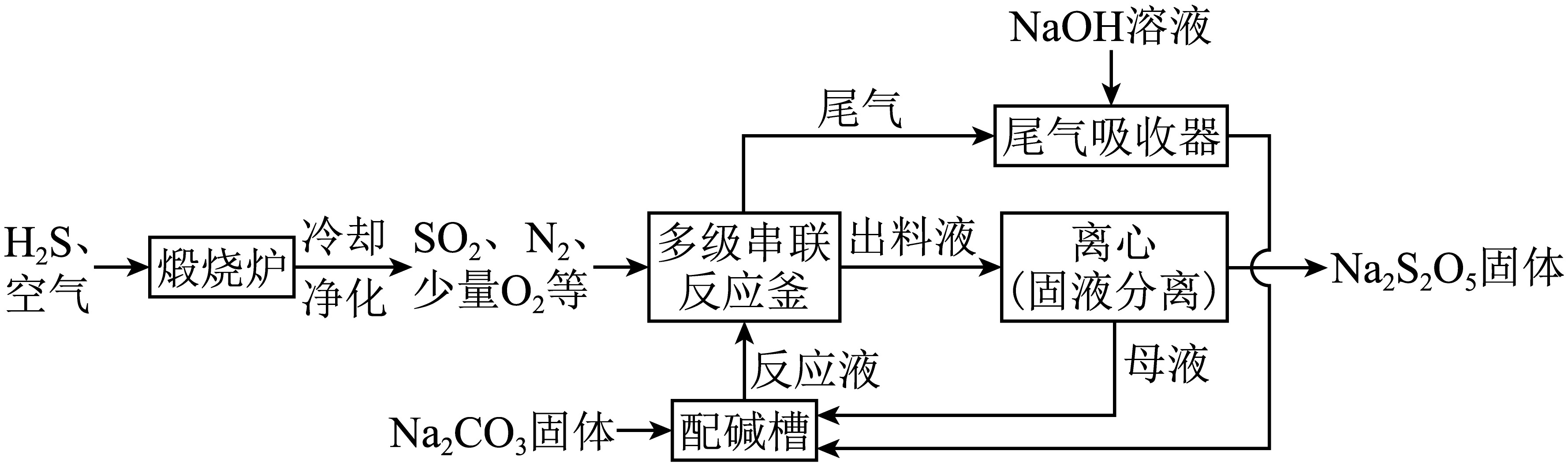
利用工业废气中的${{\text{H}}_{\text{2}}}\text{S}$制备焦亚硫酸钠$\rm (\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}\rm )$的一种流程示意图如下。
已知:
| 物质 | ${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$ | ${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$ | |
| ${{K}_{\text{a}}}\left( \text{25}\ {}^\circ \text{C} \right)$ | ${{K}_{\text{a1}}}\text{=4}\text{.5}\times \text{1}{{\text{0}}^{\text{-7}}}$、${{K}_{\text{a2}}}\text{=4}\text{.7}\times \text{1}{{\text{0}}^{\text{-11}}}$ | ${{K}_{\text{a1}}}\text{=1}\text{.4}\times \text{1}{{\text{0}}^{\text{-2}}}$ | ${{K}_{\text{a2}}}\text{=6}\text{.0}\times \text{1}{{\text{0}}^{\text{-8}}}$ |
制$\text{S}{{\text{O}}_{\text{2}}}$
已知:
${{\text{H}}_{\text{2}}}\text{S(g)+}\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\text{(g)=S(s)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=-221}\text{.2 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\text{S(s)+}{{\text{O}}_{\text{2}}}\text{(g)=S}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta H\text{=-296}\text{.8 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
由${{\text{H}}_{\text{2}}}\text{S}$制$\text{S}{{\text{O}}_{\text{2}}}$的热化学方程式为 。
$\\text{2}{{\\text{H}}_{\\text{2}}}\\text{S(g)+3}{{\\text{O}}_{\\text{2}}}\\text{(g)=2S}{{\\text{O}}_{\\text{2}}}\\text{(g)+2}{{\\text{H}}_{\\text{2}}}\\text{O(g)}\\quad \\Delta H=\\text{-1036}\\text{.8 kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
"]]已知:
反应Ⅰ:${{\text{H}}_{\text{2}}}\text{S(g)+}\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\text{(g)=S(s)+}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=-221}\text{.2 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应Ⅱ:$\text{S(s)+}{{\text{O}}_{\text{2}}}\text{(g)=S}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta H\text{=-296}\text{.8 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
将Ⅰ$\rm \times 2+$Ⅱ$\rm \times 2$得:$\text{2}{{\text{H}}_{\text{2}}}\text{S(g)+3}{{\text{O}}_{\text{2}}}\text{(g)=2S}{{\text{O}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H\text{=(-221}\text{.2}\times \text{2)+(-296}\text{.8}\times \text{2) kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=\text{-1036}\text{.8 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,所以由${{\text{H}}_{\text{2}}}\text{S}$制$\text{S}{{\text{O}}_{\text{2}}}$的热化学方程式为$\text{2}{{\text{H}}_{\text{2}}}\text{S(g)+3}{{\text{O}}_{\text{2}}}\text{(g)=2S}{{\text{O}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta H=\text{-1036}\text{.8 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
制$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}$
$\rm I$.在多级串联反应釜中,$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$悬浊液与持续通入的$\text{S}{{\text{O}}_{\text{2}}}$进行如下反应:
第一步:$\text{2N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{+S}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}\text{+2NaHC}{{\text{O}}_{\text{3}}}$
第二步:
$\text{NaHC}{{\text{O}}_{\text{3}}}\text{+S}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{NaHS}{{\text{O}}_{\text{3}}}\text{+C}{{\text{O}}_{\text{2}}}$
$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}\text{+S}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{2NaHS}{{\text{O}}_{\text{3}}}$
Ⅱ.当反应釜中溶液$\text{pH}$达到$\rm 3.8$~$\rm 4.1$时,形成的$\text{NaHS}{{\text{O}}_{\text{3}}}$悬浊液转化为$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}$固体。
①Ⅱ中生成$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}$的化学方程式是 。
②配碱槽中,母液和过量$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$配制反应液,发生反应的化学方程式是 。
③多次循环后,母液中逐渐增多的杂质离子是 ,需除去。
④尾气吸收器中,吸收的气体有 。
$\\text{2NaHS}{{\\text{O}}_{\\text{3}}}=\\text{N}{{\\text{a}}_{\\text{2}}}{{\\text{S}}_{\\text{2}}}{{\\text{O}}_{\\text{5}}}+{{\\text{H}}_{2}}\\text{O}$ ; $\\text{NaHC}{{\\text{O}}_{\\text{3}}}\\text{+S}{{\\text{O}}_{\\text{2}}}\\rightleftharpoons \\text{NaHS}{{\\text{O}}_{\\text{3}}}\\text{+C}{{\\text{O}}_{\\text{2}}}$ ; $\\text{SO}_{4}^{2-}$ ; $\\text{C}{{\\text{O}}_{\\text{2}}}$
"]]① 当反应釜中溶液$\text{pH}$达到$\rm 3.8$~$\rm 4.1$时,形成的$\text{NaHS}{{\text{O}}_{\text{3}}}$悬浊液转化为$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}$固体,根据元素守恒,还有水生成,化学方程式:$\text{2NaHS}{{\text{O}}_{\text{3}}}=\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{5}}}+{{\text{H}}_{2}}\text{O}$;
② 根据多级串联反应釜中的化学方程式可知,除了生成的焦亚硫酸钠外,母液中有亚硫酸氢钠剩余,又因为${{K}_{\text{a2}}}\left( {{\text{H}}_{2}}\text{S}{{\text{O}}_{3}} \right)\gt {{K}_{\text{a2}}}\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)$,亚硫酸氢钠与过量$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$发生反应的化学方程式为:$\text{NaHS}{{\text{O}}_{\text{3}}}+\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}=\text{NaHC}{{\text{O}}_{\text{3}}}+\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$;
③ 在燃烧炉中反应冷却后的气体中混有氧气,氧气能氧化亚硫酸钠或亚硫酸氢钠,生成硫酸钠,所以多次循环后,母液中逐渐增多的杂质离子是$\text{SO}_{4}^{2-}$,需除去;
④ 碳酸氢钠与二氧化硫发生的化学方程式为,$\text{NaHC}{{\text{O}}_{\text{3}}}\text{+S}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{NaHS}{{\text{O}}_{\text{3}}}\text{+C}{{\text{O}}_{\text{2}}}$,生成了二氧化碳,二氧化碳用氢氧化钠吸收,转化成碳酸钠,可到多级串联反应釜中循环使用,所以尾气吸收器中,吸收的气体有$\text{C}{{\text{O}}_{\text{2}}}$;
理论研究$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$、$\text{NaHC}{{\text{O}}_{\text{3}}}$与$\text{S}{{\text{O}}_{\text{2}}}$的反应。一定温度时,在$\text{1 L}$浓度均为$\text{1 mol/L}$的$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$和$\text{NaHC}{{\text{O}}_{\text{3}}}$的混合溶液中,随$n\left( \text{S}{{\text{O}}_{\text{2}}} \right)$的增加,$\text{SO}_{\text{3}}^{\text{2-}}$和$\text{HCO}_{\text{3}}^{-}$平衡转化率的变化如图。
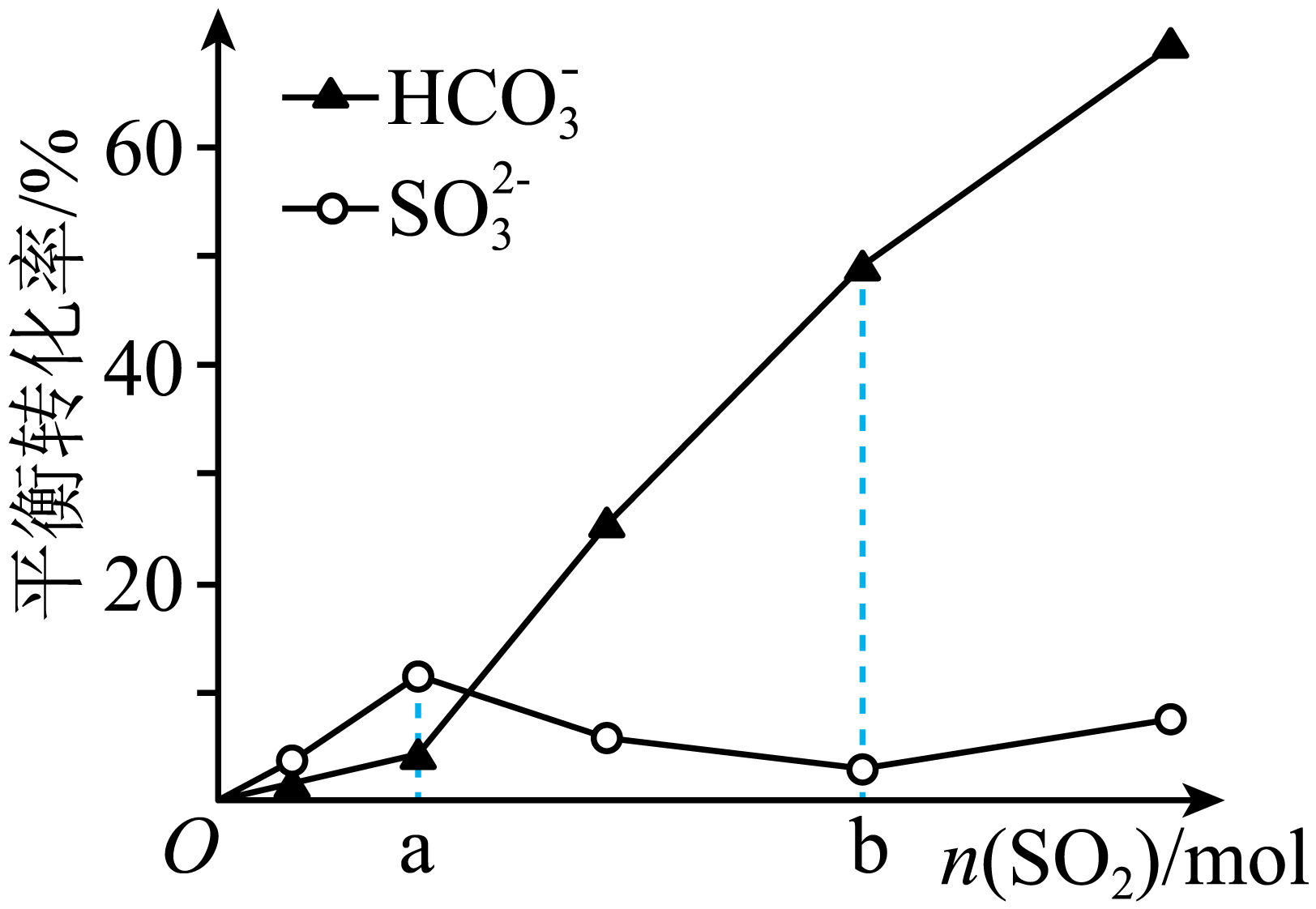
①$0\sim a\text{ mol}$,与$\text{S}{{\text{O}}_{\text{2}}}$优先反应的离子是 。
②$a\sim b\text{ mol}$,$\text{HCO}_{\text{3}}^{-}$平衡转化率上升而$\text{SO}_{\text{3}}^{\text{2-}}$平衡转化率下降,结合方程式解释原因: 。
$\\text{SO}_{3}^{2-}$ ; $a\\sim b\\text{ mol}$时,产生的二氧化碳逸出,使反应正向进行,$\\text{HCO}_{\\text{3}}^{-}$平衡转化率上升,亚硫酸氢根浓度增大,抑制了的亚硫酸根和二氧化硫的反应,所以$\\text{HCO}_{\\text{3}}^{-}$平衡转化率上升而$\\text{SO}_{\\text{3}}^{\\text{2-}}$平衡转化率下降
"]]① 由图可知,①$0\sim a\text{ mol}$,时,碳酸氢根平衡转化率较低,而亚硫酸根的平衡转化率较高,所以$\text{SO}_{3}^{2-}$与$\text{S}{{\text{O}}_{\text{2}}}$优先反应;
②一定温度时,在$\text{1 L}$浓度均为$\text{1 mol}\cdot {{\text{L}}^{\text{-1}}}$的$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$和$\text{NaHC}{{\text{O}}_{\text{3}}}$的混合溶液中,发生的反应为:$\text{SO}_{\text{3}}^{\text{2-}}\text{+S}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons 2\text{HSO}_{3}^{-}$,$\text{HCO}_{3}^{-}+\text{S}{{\text{O}}_{2}}\rightleftharpoons \text{HSO}_{3}^{-}+\text{C}{{\text{O}}_{2}}$,$a\sim b\text{ mol}$时,产生的二氧化碳逸出,使反应正向进行,$\text{HCO}_{\text{3}}^{-}$平衡转化率上升,亚硫酸氢根浓度增大,抑制了的亚硫酸根和二氧化硫的反应,所以$\text{HCO}_{\text{3}}^{-}$平衡转化率上升而$\text{SO}_{\text{3}}^{\text{2-}}$平衡转化率下降。
高中 | 盖斯定律题目答案及解析(完整版)
