| 原电池工作原理 题目答案及解析
稿件来源:高途
| 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
一种以二硫化钼$\left( \text{Mo}{{\text{S}}_{2}} \right)$作为电极催化剂的电池系统,将尾气中$\rm NO$转化为$\text{N}{{\text{H}}_{3}}$的同时获得电能,其工作原理如图所示$\rm ($双极膜可将水电离为${{\text{H}}^{+}}$和$\text{O}{{\text{H}}^{-}}$,并能定向通过$\rm )$。下列说法正确的是$(\quad\ \ \ \ )$
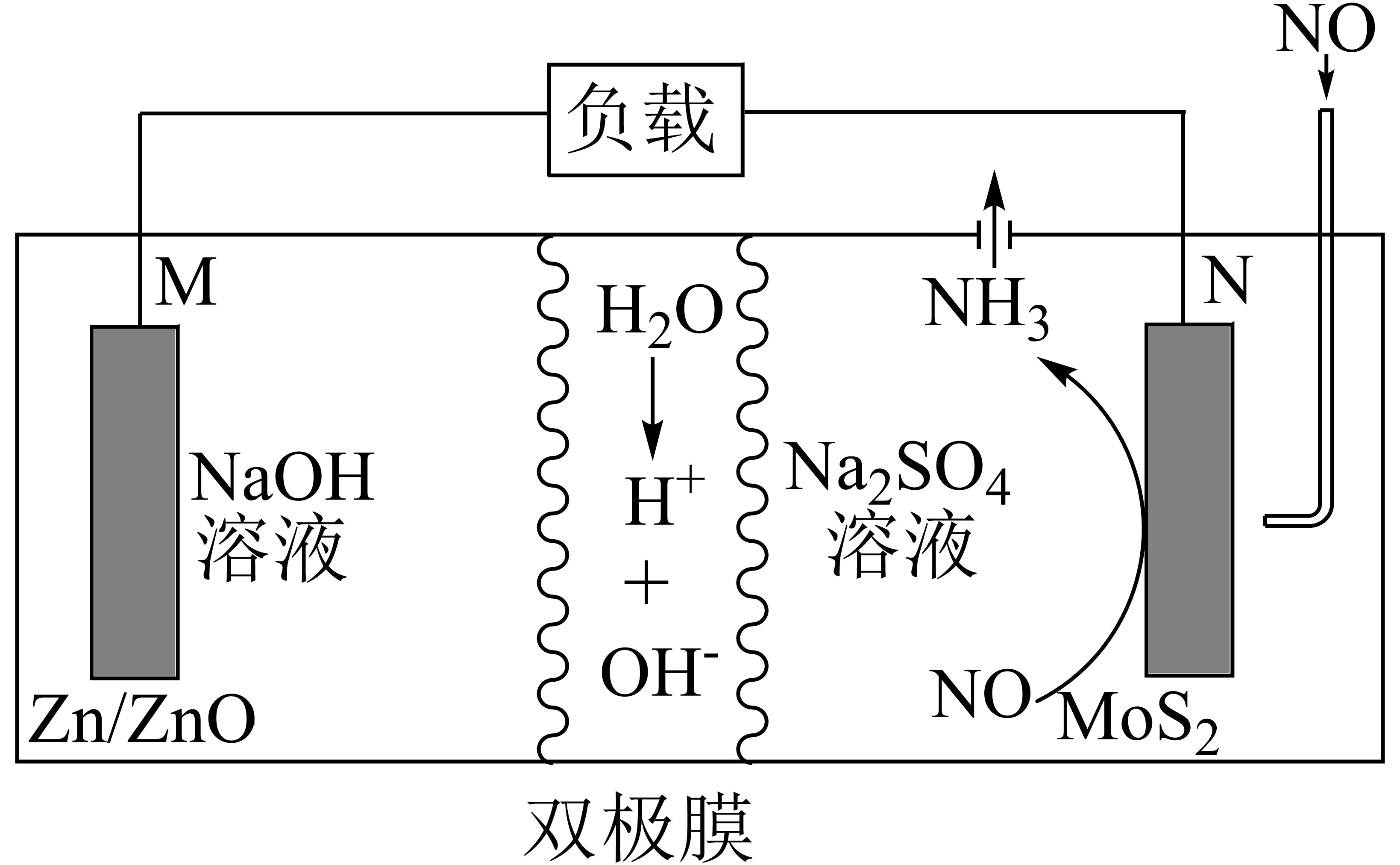
双极膜中$\\text{O}{{\\text{H}}^{-}}$移向$\\text{N}{{\\text{a}}_{2}}\\text{S}{{\\text{O}}_{4}}$溶液
","$\\rm M$极的电极反应为$\\text{Zn}-2{{\\text{e}}^{-}}+2\\text{O}{{\\text{H}}^{-}}=\\text{Zn}{{\\left( \\text{OH} \\right)}_{2}}$
","电解过程中两极室的电解质溶液的浓度均减小
","当$\\rm M$极质量增大$\\rm 16\\;\\rm g$,则$\\rm N$极生成的$\\text{N}{{\\text{H}}_{3}}$在标准状况下的体积为$\\rm 11.2\\;\\rm L$
"]由图可知,$\rm Zn/ZnO$电极为负极,失电子发生氧化反应,电极反应式为$\rm Zn-2e^{-}+2OH^{-}=ZnO+H_{2}O$,$\rm MoS_{2}$电极为正极,电极反应式为$\rm NO+5e^{-}+5H^{+}=NH_{3}+H_{2}O$,两极区均有水生成,双极膜可将水解离为$\rm H^{+}$和$\rm OH^{-}$,并实现其定向通过,据此分析。
$\rm A$.$\rm Zn/ZnO$为负极,电极反应为$\text{Zn}-2{{\text{e}}^{-}}+2\text{O}{{\text{H}}^{-}}=\text{ZnO}+{{\text{H}}_{2}}\text{O}$,$\rm MoS$为正极,电极反应为$\text{NO}+5{{\text{e}}^{-}}+5{{\text{H}}^{+}}=\text{N}{{\text{H}}_{3}}\uparrow +{{\text{H}}_{2}}\text{O}$,故双极膜中${{\text{H}}^{+}}$移向正极区$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$溶液,$\text{O}{{\text{H}}^{-}}$移向$\rm NaOH$溶液,$\rm A$错误;
$\rm B$.由上述分析可知,$\rm M$极反应应生成$\rm ZnO$,$\rm B$错误;
$\rm C$.电解过程中两极均生成${{\text{H}}_{2}}\text{O}$,电解质溶液的浓度均减小,$\rm C$正确;
当$\rm M$极质量增大$\rm 16$ $\rm g$,电路中转移$\rm 2$ $\rm mol$电子,在$\rm N$极生成$0.4\text{ mol N}{{\text{H}}_{3}}$,标准状况下为$\rm 8.96\;\rm L$,$\rm D$错误;
故选:$\rm C$
| 原电池工作原理题目答案及解析(完整版)
