高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
丙烯是有机化工中的重要原料,可用丙烷直接脱氢工艺和丙烷氧化脱氢工艺制备。
$\rm I$.丙烷直接脱氢工艺,以金属$\text{Pt}$为催化剂,存在以下两个反应:
主反应:${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$
副反应:${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$
其主反应中有关物质的燃烧热数据如下:
| 物质 | ${{\text{C}}_{3}}{{\text{H}}_{8}}$ | ${{\text{C}}_{3}}{{\text{H}}_{6}}$ | ${{\text{H}}_{2}}$ |
| 燃烧热$\Delta H/\left( \text{kJ}/\text{mol} \right)$ | $\rm -2219.9$ | $\rm -2058.0$ | $\rm -285.8$ |
回答下列问题:
主反应的$\Delta H=$ $\;\rm \text{kJ}/\text{mol}$。主反应自发进行的条件是 。
$\\rm +123.9$;高温
"]]$\rm C_{3}H_{8}$燃烧热的热化学方程式:${\rm C_{3}H_{8}(g)+5O_{2}(g)=3CO_{2}(g)+4H_{2}O(l)}\qquad \Delta H=-2219.9\;\rm kJ·mol^{-1}$ ①;
$\rm C_{3}H_{6}$燃烧热的热化学方程式:${\rm C_{3}H_{6}(g)+\dfrac{9}{2}\rm O_{2}(g)=3CO_{2}(g)+3H_{2}O(l)}\qquad \Delta H=-2058.0\;\rm kJ·mol^{-1}$②;
$\rm H_{2}$燃烧热的热化学方程式为${\rm H_{2}(g)+\dfrac{1}{2}\rm O_{2}(g)= H_{2}O(l)}\qquad \Delta H=-285.8\;\rm kJ·mol^{-1}$ ③。
根据盖斯定律,①$\rm -$②$\rm -$③可得到反应${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$,则$ \Delta H=-2219.9\;\rm kJ·mol^{-1}-(-2058.0\;\rm kJ·mol^{-1})-(-285.8\;\rm kJ·mol^{-1})=+123.9\;\rm kJ·mol^{-1}$;
主反应$\Delta H\gt 0$,气体物质的量增多$\Delta S\gt 0$,自发进行的条件是高温。
下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系$\rm ($图中的压强分别为$1\times {{10}^{4}}\ \text{Pa}$和$1\times {{10}^{5}}\ \text{Pa}\rm )$。
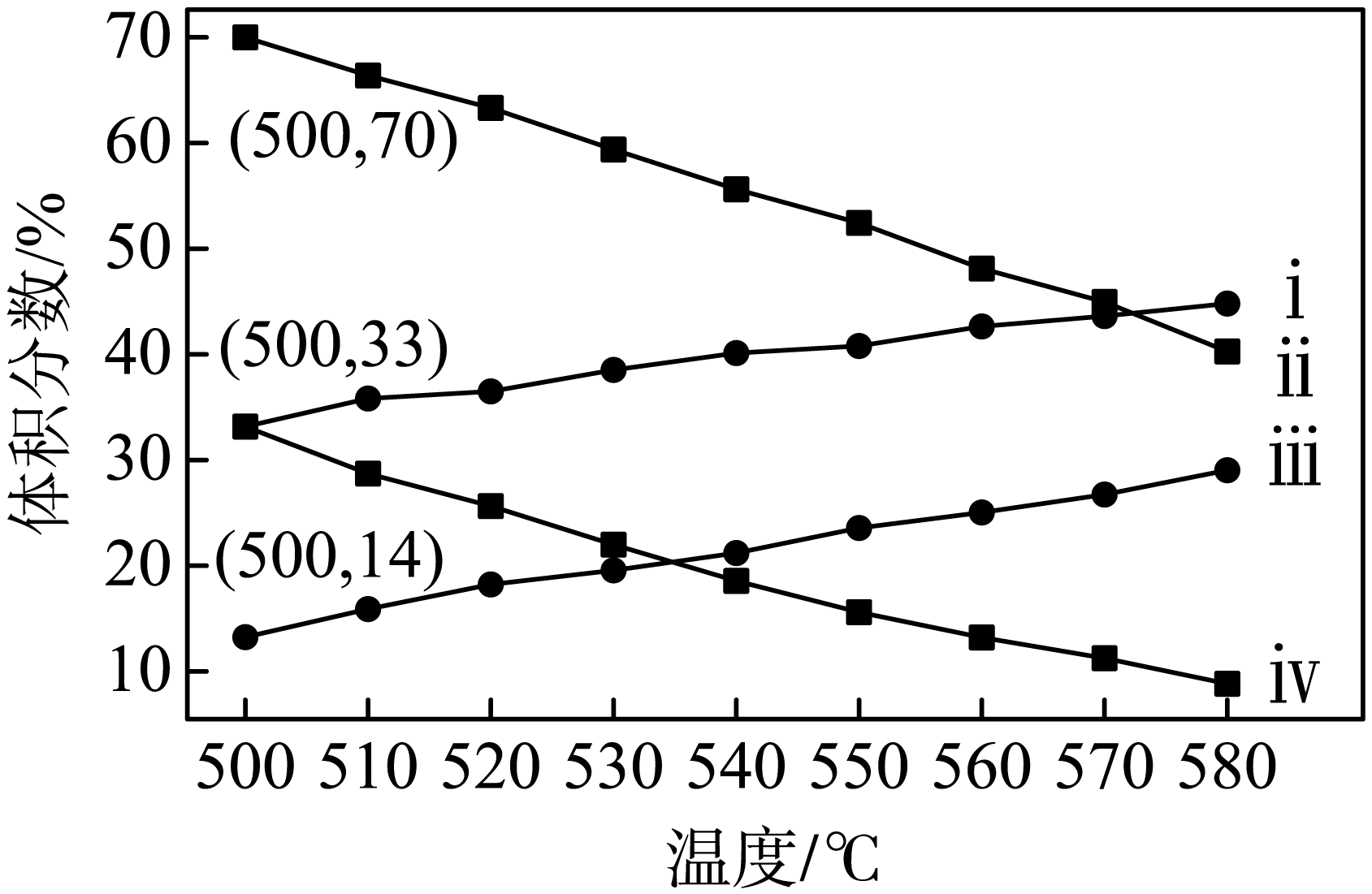
①$1\times {{10}^{4}}\ \text{Pa}$时,图中表示丙烯的曲线是 $\rm ($填“$\rm i$”、“$\rm ii$”、“$\rm iii$”或“$\rm iv$”$\rm )$。
②$1\times {{10}^{5}}\ \text{Pa}$、$\rm 500\;\rm ^\circ\rm C$时,在密闭容器中进行反应,若只发生上述主反应和副反应,则达平衡时,丙烷的转化率为 $\rm ($保留$\rm 3$位有效数字$\rm )$。其他条件不变情况下,以下操作有利于提高平衡时$ {n}\left( {{\text{C}}_{3}}{{\text{H}}_{6}} \right)$的操作有 。
$\rm A$.恒压通入适量$\rm {{\text{N}}_{2}}$ $\rm B$.加入适量$\rm \text{CuO}$
$\rm C$.提高$\rm \text{Pt}$的表面积 $\rm D$.加入浸泡了$\rm \text{KMn}{{\text{O}}_{4}}$的硅藻土
$\\rm i$;$\\rm 17.6\\%$;$\\rm AB$
"]]①正反应吸热,升高温度平衡正向移动,丙烯体积分数增大;正反应气体系数和增大,增大压强,平衡逆向移动,丙烯的体积分数降低,所以$1\times {{10}^{4}}\ \text{Pa}$时图中表示丙烯的曲线是$\rm i$。
②$\rm 1\times {{10}^{5}}\ {Pa}$、$\rm 500\;\rm ^\circ\rm C$时,在密闭容器中进行反应,根据图示,达平衡时丙烷的平衡体积分数为$\rm 70\%$,设丙烷的投料为$x\;\rm mol$,若只发生上述主反应和副反应,消耗丙烷的物质的量为$a\;\rm mol$,则反应生成的丙烯、氢气、乙烯、甲烷的总物质的量为$2a\;\rm mol$,$\dfrac{{x-a}}{{x+a}}=70\%$,则丙烷的转化率为$\dfrac{{a}}{{x}}\times 100\%=17.6\%$。
$\rm A$.恒压通入适量${{\text{N}}_{2}}$,相当于减压,平衡正向移动,$ {n}\left( {{\text{C}}_{3}}{{\text{H}}_{6}} \right)$增大,故选:$\rm A$;
$\rm B$.加入适量$\text{CuO}$,$\text{CuO}$和氢气反应,氢气浓度降低,正反应正向移动,$ {n}\left( {{\text{C}}_{3}}{{\text{H}}_{6}} \right)$增大,故选:$\rm B$;
$\rm C$.提高$\text{Pt}$的表面积,平衡不移动,$ {n}\left( {{\text{C}}_{3}}{{\text{H}}_{6}} \right)$不变,故不选$\rm C$;
$\rm D$.加入浸泡了$\text{KMn}{{\text{O}}_{4}}$的硅藻土,$\text{KMn}{{\text{O}}_{4}}$氧化丙烯、乙烯等烯烃,$ {n}\left( {{\text{C}}_{3}}{{\text{H}}_{6}} \right)$减小,故不选$\rm D$;
选$\rm AB$。
$\rm I$$\rm I$.丙烷氧化脱氢工艺:$2{{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2{{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$
在相同温度、压强下进行该工艺,将${{\text{O}}_{2}}$、${{\text{C}}_{3}}{{\text{H}}_{8}}$和${{\text{N}}_{2}}$按不同比例投料,控制${{\text{C}}_{3}}{{\text{H}}_{8}}$浓度不变,改变$ {n}\left( {{\text{O}}_{2}} \right):{n}\left( {{\text{C}}_{3}}{{\text{H}}_{8}} \right)$。每组实验反应相同时间后,${{\text{C}}_{3}}{{\text{H}}_{8}}$转化率和${{\text{C}}_{3}}{{\text{H}}_{6}}$产率如下图所示。已知各组反应均未达平衡,催化剂活性无明显变化,解释${{\text{C}}_{3}}{{\text{H}}_{6}}$产率先增后降的原因: 。
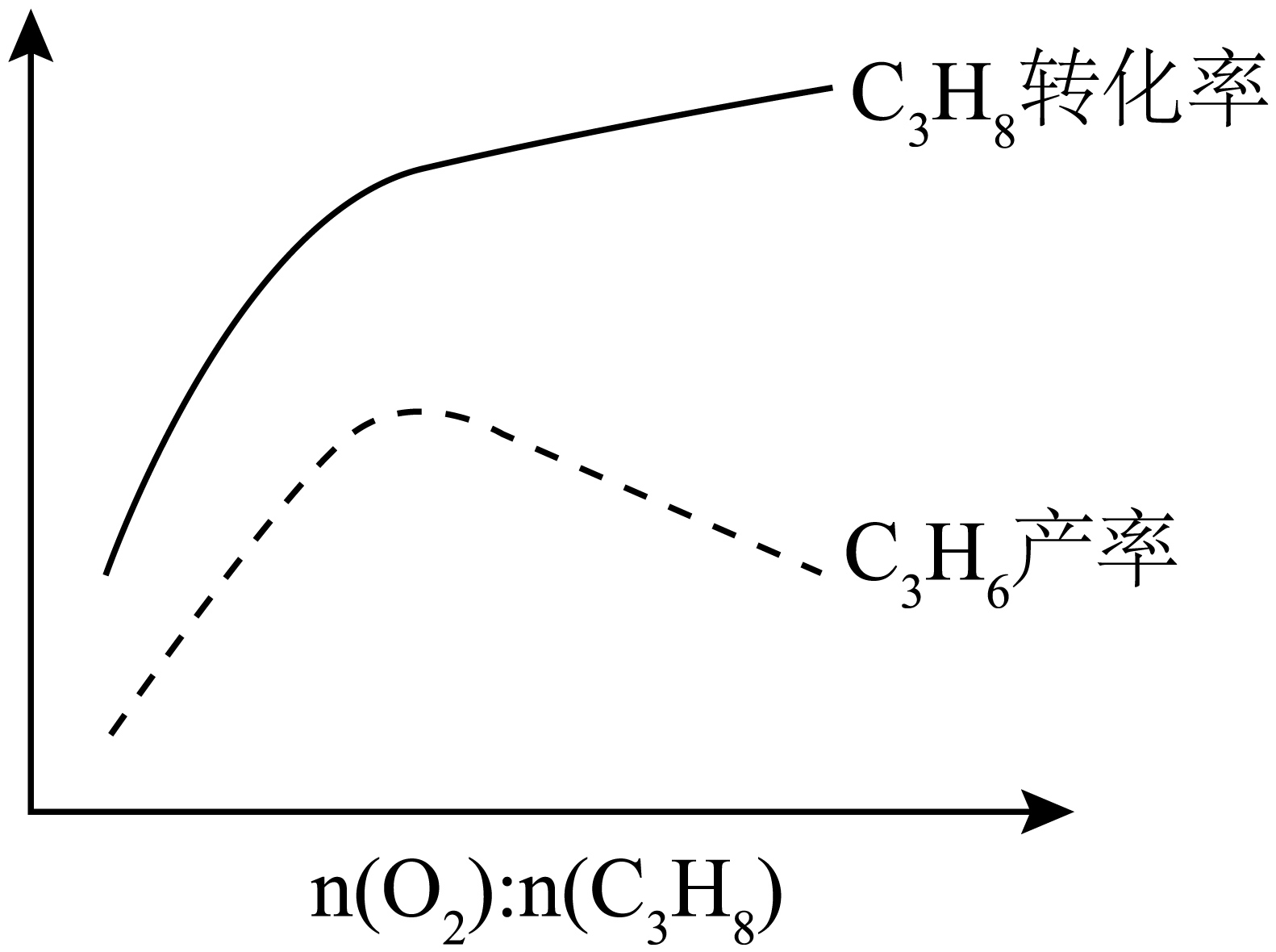
$\\rm O_{2}$浓度增大使反应速率变快,产率升高;后因过量$\\rm O_{2}$氧化$\\rm C_{3}H_{6}$,产率下降
"]]$\rm O_{2}$浓度增大使反应速率变快,产率升高,后因过量的$\rm O_{2}$氧化$\rm C_{3}H_{6}$,产率下降,所以${{\text{C}}_{3}}{{\text{H}}_{6}}$产率先增后降。
$\rm II$$\rm I$.工业上可利用丙烯进行电有机合成制备$\rm 1$,$\rm 2-$丙二醇。
写出以稀硫酸为电解液,丙烯在电极上生成$\rm 1$,$\rm 2-$丙二醇的电极反应方程式: 。
$\\text{C}{{\\text{H}}_{2}}=\\text{CHC}{{\\text{H}}_{3}}+2{{\\text{H}}_{2}}\\text{O}-2{{\\text{e}}^{-}}=\\text{C}{{\\text{H}}_{2}}\\left( \\text{OH} \\right)-\\text{CH}\\left( \\text{OH} \\right)-\\text{C}{{\\text{H}}_{3}}+2{{\\text{H}}^{+}}$
"]]丙烯生成$\rm 1$,$\rm 2-$丙二醇,碳元素化合价升高发生氧化反应,所以丙烯在阳极得电子生成$\rm 1$,$\rm 2-$丙二醇,阳极的电极反应方程式为$\text{C}{{\text{H}}_{2}}=\text{CHC}{{\text{H}}_{3}}+2{{\text{H}}_{2}}\text{O}-2{{\text{e}}^{-}}=\text{C}{{\text{H}}_{2}}\left( \text{OH} \right)-\text{CH}\left( \text{OH} \right)-\text{C}{{\text{H}}_{3}}+2{{\text{H}}^{+}}$。
高中 | 盖斯定律题目答案及解析(完整版)
