| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{C}{{\text{O}}_{2}}$加氢制备$\text{C}{{\text{H}}_{3}}\text{OH}$、$\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}$涉及反应如下:
$\rm i$.$2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+6{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+3{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}$
$\rm ii$.$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-49.9\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$\rm iii$.$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{3}}=+41.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
回答下列问题:
工业上,利用$\text{CO}$加氢合成$\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)$的热化学方程式为 。
$2{{\\text{H}}_{2}}\\left( \\text{g} \\right)+\\text{CO}\\left( \\text{g} \\right)\\rightleftharpoons \\text{C}{{\\text{H}}_{3}}\\text{OH}\\left( \\text{g} \\right)\\quad \\Delta H=-91.5\\ \\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]根据盖斯定律,反应$\rm ii-iii$可得$2{{\text{H}}_{2}}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)$,则该反应的$\Delta H=(-49.9\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}})-(+41.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}})=-91.5\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,则利用$\text{CO}$加氢合成$\text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)$的热化学方程式为:$2{{\text{H}}_{2}}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)\quad \Delta H=-91.5\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
向反应器中充入$1\ \text{mol}\,\text{C}{{\text{O}}_{2}}$和$3\ \text{mol}\,{{\text{H}}_{2}}$,在催化剂$\text{Cat}1$、$\text{Cat}2$作用下发生上述反应,测得相同时间内$\text{C}{{\text{O}}_{2}}$的转化率与温度关系如图所示。温度低于$\rm 450\;\rm ^\circ\rm C$时,催化效率较高的催化剂是 $\rm ($填“$\text{Cat}1$”或“$\text{Cat}2$”$\rm )$,随着温度升高,$\text{Cat}1$、$\text{Cat}2$曲线相交,其主要原因可能是 。
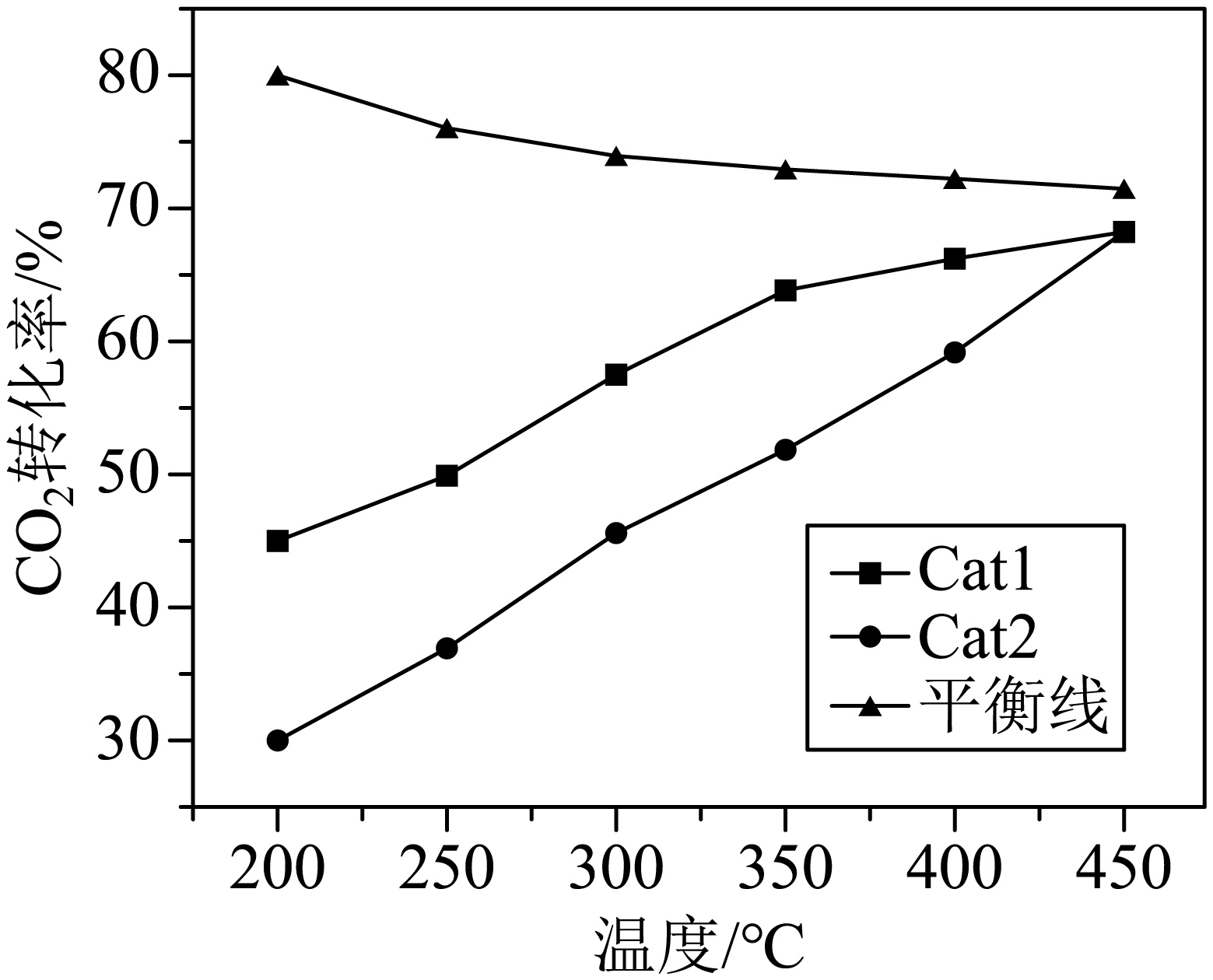
$\\text{Cat}1$ ; 随着温度升高,温度对反应速率起决定作用
"]]由图可知,温度低于$\rm 450\;\rm ^\circ\rm C$时,催化剂是$\text{Cat}1$时,二氧化碳的转化率高,故此时催化效率较高的催化剂是;由于反应时间相同,随着温度升高,反应速率加快,则随着温度升高,$\text{Cat}1$、$\text{Cat}2$曲线相交,其主要原因可能是:随着温度升高,温度对反应速率起决定作用;
某温度下,向恒容密闭容器中充入$1\ \text{mol}\,\text{C}{{\text{O}}_{2}}$和$3\ \text{mol}\,{{\text{H}}_{2}}$,发生上述反应$\rm i$、$\rm ii$、$\rm iii$,起始压强为$100\,\text{kPa}$,达到平衡时$\text{C}{{\text{O}}_{2}}$转化率为$\rm 60\%$,$\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}$选择性为$\rm 50\%$,$\text{CO}$选择性为$\rm 25\%$。
已知:乙醇的选择性$=\dfrac{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)}{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)+n\left( \text{C}{{\text{H}}_{3}}\text{OH} \right)+n\left( \text{CO} \right)}\times 100\%\rm (\text{C}{{\text{H}}_{3}}\text{OH}$、$\text{CO}$的选择性同理$\rm )$。$\rm )$
该温度下,反应$\rm iii$的平衡常数${{K}_{\text{p}}}=$ $\rm ($用分数表示,用分压计算的平衡常数为压强平衡常数,分压等于总压$\rm \times $物质的量分数$\rm )$。
$\\dfrac{1}{7}$
"]]根据相关数据,达到平衡时$\text{C}{{\text{O}}_{2}}$转化率为$\rm 60\%$,$\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}$选择性为$\rm 50\%$,$\text{CO}$选择性为$\rm 25\%$,根据原子守恒可计算各组分物质的量如下:
| 组分 | $\text{C}{{\text{O}}_{2}}$ | $\text{CO}$ | ${{\text{H}}_{2}}$ | ${{\text{H}}_{2}}\text{O}$ | $\text{C}{{\text{H}}_{3}}\text{OH}$ | ${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}$ |
| $n/\text{mol}$ | $\rm 0.4$ | $\rm 0.1$ | $\rm 1.4$ | $\rm 0.8$ | $\rm 0.1$ | $\rm 0.2$ |
气体总物质的量为$3.0\ \text{mol}$。对于等分子数反应,可用物质的量替代分压计算平衡常数,反应$\rm iii$的平衡常数${{K}_{\text{p}}}=\dfrac{p\left( \text{CO} \right)\cdot p\left( {{\text{H}}_{2}}\text{O} \right)}{p\left( \text{C}{{\text{O}}_{2}} \right)\cdot p\left( {{\text{H}}_{2}} \right)}=\dfrac{0.1\ \text{mol}\times 0.8\ \text{mol}}{0.4\ \text{mol}\times 1.4\ \text{mol}}=\dfrac{1}{7}$;
$\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$在活化后的催化剂$\rm [$催化剂活化:$\text{I}{{\text{n}}_{2}}{{\text{O}}_{3}}\rm ($无活性$)\overset{还原}{\underset{氧化}{\rightleftharpoons}}\text{I}{{\text{n}}_{2}}{{\text{O}}_{3-x}}\rm .($有活性$\rm )]$表面可逆地发生反应$\rm ii$,其反应历程如图所示。
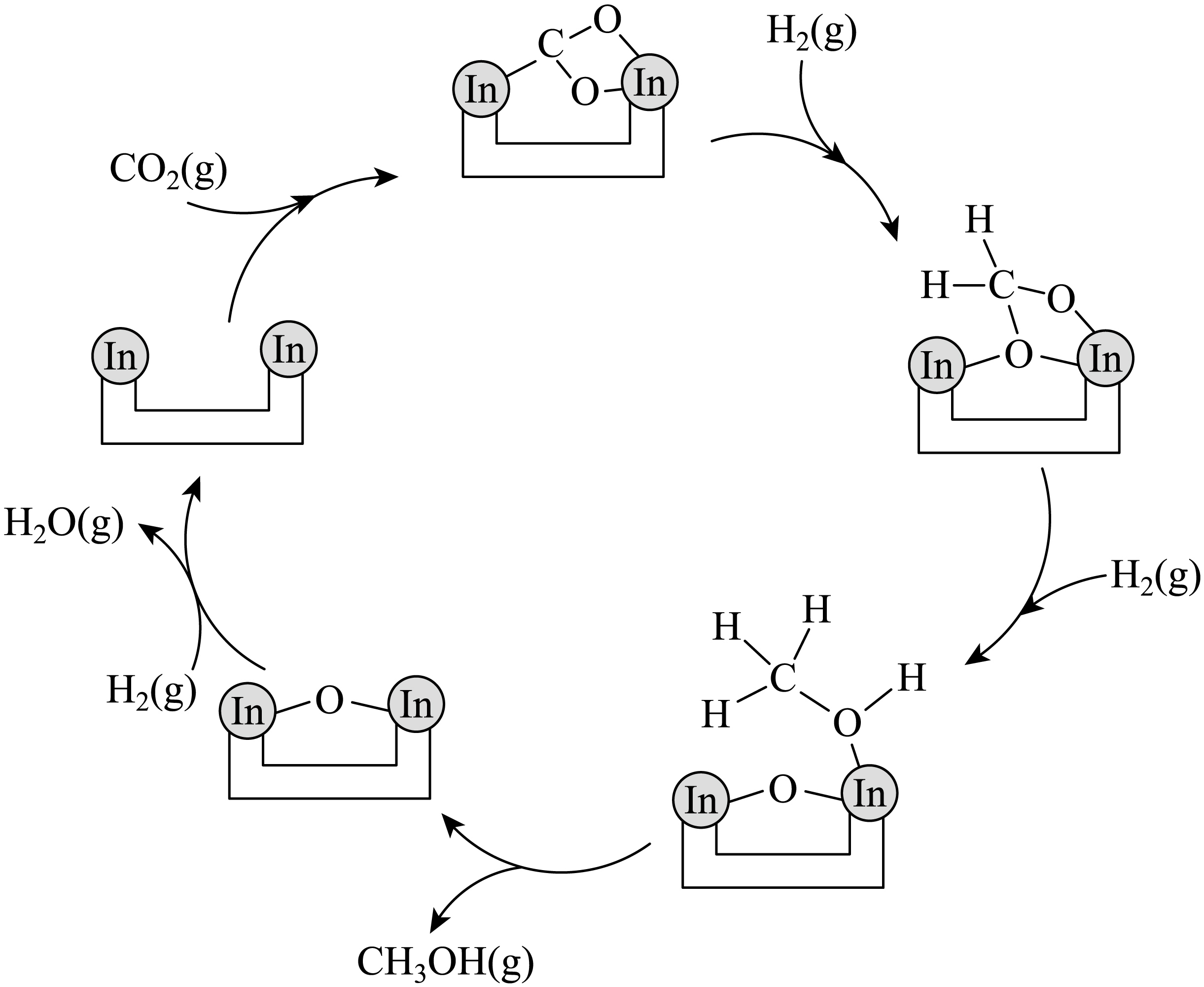
①对于$\text{C}{{\text{O}}_{2}}$制甲醇的过程,以下描述正确的是 $\rm ($填字母$\rm )$。
$\rm A$.反应中经历了$\text{In}-\text{C}$、$\text{In}-\text{O}$键的形成和断裂
$\rm B$.加压可以提高$\text{C}{{\text{O}}_{2}}$的平衡转化率
$\rm C$.升高温度有利于生成甲醇
②$\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$混合气体以不同的流速通过反应器,流速加快可减少产物中${{\text{H}}_{2}}\text{O}$的积累,减少反应 $\rm ($用化学方程式表示$\rm )$的发生,减少催化剂的失活,提高甲醇选择性。
$\\rm AB$ ; $\\text{I}{{\\text{n}}_{2}}{{\\text{O}}_{3-x}}+x{{\\text{H}}_{2}}\\text{O}\\rightleftharpoons \\text{I}{{\\text{n}}_{2}}{{\\text{O}}_{3}}+x{{\\text{H}}_{2}}$
"]]①$\rm A$.由图可知,反应中经历了$\text{In}-\text{C}$、$\text{In}-\text{O}$键的形成和断裂,$\rm A$项正确;
$\rm B$.$\text{C}{{\text{O}}_{2}}$制甲醇是气体分子数减小的反应,加压平衡正向移动,可以提高$\text{C}{{\text{O}}_{2}}$的平衡转化率,$\rm B$项正确;
$\rm C$.$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-49.9\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$是放热反应,升高温度平衡逆向移动,不利于生成甲醇,$\rm C$项错误;
故选:$\rm AB$;
②已知催化剂活化:$\text{I}{{\text{n}}_{2}}{{\text{O}}_{3}}\rm ($无活性$)\overset{还原}{\underset{氧化}{\rightleftharpoons}}\text{I}{{\text{n}}_{2}}{{\text{O}}_{3-x}}\rm ($有活性$\rm )$,流速加快可减少产物中${{\text{H}}_{2}}\text{O}$的积累,减少反应$\text{I}{{\text{n}}_{2}}{{\text{O}}_{3-x}}+x{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{I}{{\text{n}}_{2}}{{\text{O}}_{3}}+x{{\text{H}}_{2}}$的发生,减少催化剂的失活,提高甲醇选择性;
用电解法也可以实现由$\text{C}{{\text{O}}_{2}}$制备乙醇。电解时电解质溶液显酸性,阴极的电极反应式为 。
$2\\text{C}{{\\text{O}}_{2}}+12{{\\text{H}}^{+}}+12{{\\text{e}}^{-}}={{\\text{C}}_{2}}{{\\text{H}}_{5}}\\text{OH}+3{{\\text{H}}_{2}}\\text{O}$
"]]根据题意,电解时,二氧化碳在阴极得到电子生成乙醇,电极反应式为:$2\text{C}{{\text{O}}_{2}}+12{{\text{H}}^{+}}+12{{\text{e}}^{-}}={{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}+3{{\text{H}}_{2}}\text{O}$;
干冰$\rm ($固态$\text{C}{{\text{O}}_{2}}\rm )$的立方晶胞结构中,$\text{C}{{\text{O}}_{2}}$处于顶点和面心,若晶胞参数为$a\ \text{nm}$,${{N}_{\text{A}}}$表示阿伏加德罗常数的值,则干冰晶体的密度为 $\text{g}\cdot \text{c}{{\text{m}}^{-3}}$。
$\\dfrac{1.76\\times {{10}^{23}}}{{{a}^{3}}{{N}_{\\text{A}}}}$
"]]干冰$\rm ($固态$\text{C}{{\text{O}}_{2}}\rm )$的立方晶胞结构中,$\text{C}{{\text{O}}_{2}}$处于顶点和面心,,则每个干冰晶胞中含有$\rm 4$个$\text{C}{{\text{O}}_{2}}$,干冰晶体的密度$ =\dfrac{4\,\text{mol}\times 44\,\text{g}/\text{mol}}{{{(a\times {{10}^{-7}})}^{3}}{{N}_{\text{A}}}}=\dfrac{1.76\times {{10}^{23}}}{{{a}^{3}}{{N}_{\text{A}}}}\,\text{g}\cdot \text{c}{{\text{m}}^{-3}}$。
| 化学平衡常数题目答案及解析(完整版)
