| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
碳的单质及其化合物是重要而值得深入探讨的研究对象。请回答:
$\text{C}{{\text{O}}_{2}}$可以被电化学还原为乙烯,写出在酸性水溶液中阴极的电极反应方程式 。
$2\\text{C}{{\\text{O}}_{2}}+12{{\\text{H}}^{+}}+12{{\\text{e}}^{-}}\\to {{\\text{C}}_{2}}{{\\text{H}}_{4}}+4{{\\text{H}}_{2}}\\text{O}$
"]]酸性条件下,$\text{C}{{\text{O}}_{\text{2}}}$在阴极得电子生成${{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}$,根据守恒配平$\text{2C}{{\text{O}}_{\text{2}}}\text{+12}{{\text{H}}^{+}}\text{+12}{{\text{e}}^{-}}\to {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\text{+4}{{\text{H}}_{\text{2}}}\text{O}$。
研究表明,表面吸附的$\rm CO$是电化学还原$\text{C}{{\text{O}}_{2}}$过程中的关键中间体。$\rm CO$在催化剂表面活性位点的吸附可以用如下反应方程式表示:$\text{CO}\left( \text{g} \right)+*\to *\text{CO}\quad {{K}_{\text{ads}}}$ ;其中*表示一个未被占据的活性位点,*$\rm CO$表示该位点被$\rm CO$占据,该反应平衡常数表示为${{K}_{\text{ads}}}\rm ($这里的$K$是标准平衡常数,是无量纲的量$\rm ){{\theta }_{\text{CO}}}$为被占据活性位点的比例,${{\theta }_{\text{CO}}}$可以用$\rm CO$的分压${{P}_{\text{CO}}}$和${{K}_{\text{ads}}}$表示,写出${{\theta }_{\text{CO}}}$的表达式 。
${{\\theta }_{\\text{CO}}}=\\dfrac{{{K}_{\\text{ads}}}{{P}_{\\text{CO}}}}{1+{{K}_{\\text{ads}}}{{P}_{\\text{CO}}}}$
"]]由${{K}_{\text{ads}}}=\dfrac{{{\theta }_{\text{CO}}}}{\text{(1-}{{\theta }_{\text{CO}}}\text{)}{{p}_{\text{CO}}}}\rm ($吸附平衡,$\text{1-}{{\theta }_{\text{CO}}}$为未被占据活性位点比例 $\rm )$,变形推导得${{\theta }_{\text{CO}}}=\dfrac{{{K}_{\text{ads}}}{{P}_{\text{CO}}}}{1+{{K}_{\text{ads}}}{{P}_{\text{CO}}}}$。
在正常情况下,人体血浆中${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$的浓度为$1.2\times {{10}^{-3}}\text{ mol/L}$,$\text{HCO}_{3}^{-}$的平衡浓度为$2.4\times {{10}^{-2}}\text{ mol/L}$。计算该条件下,人体血浆的$\rm pH$值 。$\rm ($该条件下,${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$的${{K}_{\text{a1}}}={{10}^{-6.10}}$,${{K}_{\text{a2}}}={{10}^{-10.10}}$;$\lg 2\approx 0.3\rm )$
$\\rm 7.40$
"]]${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$一级电离${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\rightleftharpoons {{\text{H}}^{+}}\text{+HCO}_{\text{3}}^{-}$,${{K}_{\text{a1}}}=\dfrac{c\text{(}{{\text{H}}^{+}}\text{)}\cdot c\text{(HCO}_{\text{3}}^{-}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{)}}$,代入数据$\text{1}{{\text{0}}^{\text{-6}\text{.10}}}=\dfrac{c\text{(}{{\text{H}}^{+}}\text{)}\times \text{2}\text{.4}\times \text{1}{{\text{0}}^{\text{-2}}}}{\text{1}\text{.2}\times \text{1}{{\text{0}}^{\text{-3}}}}$,结合$\text{lg2}\approx \text{0}\text{.3}$计算$\text{pH=-}\lg c\text{(}{{\text{H}}^{+}}\text{)=7}\text{.40}$。
焦炭是重要的还原剂,比如用来提取金属$\rm Zn$,其中一步反应在$\rm 1200$ $\rm K$下实现:反应$(1)$$\text{ZnO}+\text{C}\to \text{Zn}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)$。与碳有关的相关反应和其$\Delta G$如下:反应$\rm (a)$:$\text{C+}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}$;反应$\rm (b)$:$\text{2C+}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{2CO}$;反应$\rm (c)$:$\text{2CO+}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{2C}{{\text{O}}_{\text{2}}}$;反应$\rm (d)$:$\text{2Zn+}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{2ZnO}$。
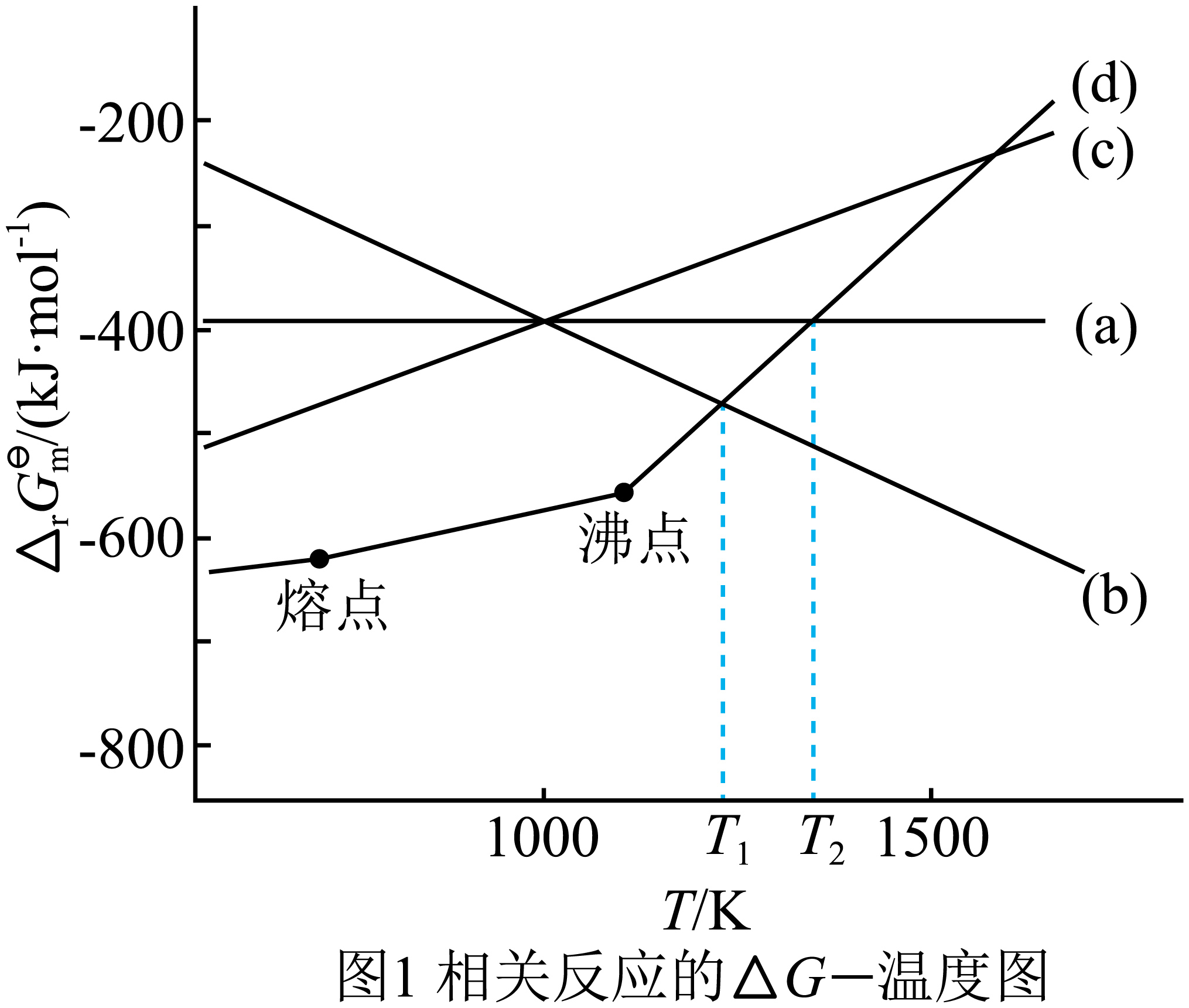
提示:$\Delta G=\Delta H-T\Delta S$;$\Delta G\lt 0$,反应正向自发;$\Delta G\gt 0$,反应逆向自发;$\Delta G=0$,反应平衡。其中$\Delta S$与混乱度有关,气体相对分子质量越大,结构越复杂,其相应的$\Delta S$也越大。
①解释为什么是在$\rm 1200$ $\rm K$下进行反应$(1)$,并说明产物为什么是$\rm CO$ 。
②如果反应$(1)$的产物是$\text{C}{{\text{O}}_{2}}$,温度需要达到 。
③判断反应$\rm (a)$的$\Delta H$ $\rm 0($填“$\rm \gt $”、“$\rm \lt $”、“$\rm =$”$\rm )$,$\Delta S$ $\rm 0($填“$\rm \gt $”、“$\rm \lt $”$\rm )$
在图$\\rm 1$相关反应的$\\Delta G\\rm —$温度图中,在$\\rm (d)$,$\\rm (b)$两线交点所对应的温度${{T}_{1}}$下,反应$\\rm (d)$和反应$\\rm (b)$的$\\Delta G$相等,这时反应$\\text{ZnO}+\\text{C}\\to \\text{Zn}\\left( \\text{g} \\right)+\\text{CO}\\left( \\text{g} \\right)$的$\\Delta G=0$,这时温度大约是$\\rm 1200$ $\\rm K$,高于这个温度,反应$\\rm (b)$的$\\Delta G$小于反应$\\rm (d)$的$\\Delta G$,碳单质还原氧化锌的反应就可以自发进行了。由于此时温度小于${{T}_{2}}$,反应的产物当然是$\\rm CO$ ; ${{{T}}_{2}}$ ; $\\rm \\lt $ ; $\\rm \\gt $
"]]在图$\rm 1$相关反应的$\Delta G\rm —$温度图中,在$\rm (d)$,$\rm (b)$两线交点所对应的温度${{T}_{1}}$下,反应$\rm (d)$和反应$\rm (b)$的$\Delta G$相等,这时反应$\text{ZnO+C}\to \text{Zn}\left( \text{g} \right)\text{+CO}\left( \text{g} \right)$的$\Delta G=0$,这时温度大约是$\rm 1200$ $\rm K$,高于这个温度,反应$\rm (b)$的$\Delta G$小于反应$\rm (d)$的$\Delta G$,碳单质还原氧化锌的反应就可以自发进行了,由于此时温度小于${{T}_{2}}$,反应的产物当然是$\rm CO$;根据$\Delta G-T$图,反应$(1)$若生成$\text{C}{{\text{O}}_{\text{2}}}$,对应$\Delta G=0$时温度为${{T}_{2}}$;$\text{C+}{{\text{O}}_{\text{2}}}\text{=C}{{\text{O}}_{\text{2}}}$是放热反应$\Delta H\lt 0$;反应后气体分子数减少$\rm ($混乱度减小$ )\Delta S\gt 0$;
解释石墨的碳碳键长小于金刚石中的碳碳键长 。
$\\rm 1$:石墨中$\\rm C$为$\\mathrm{sp}^2$杂化,金刚石中$\\rm C$为$\\text{s}{{\\text{p}}^{3}}$杂化,石墨中未参与杂化的$\\rm p$轨道相互重叠,形成大$\\pi$键$(\\pi_{n}^{n}\\rm )$,轨道重叠程度变大,键长变短;$2$:石墨中有大$\\pi$键$(\\pi_{n}^{n}\\rm )$,碳碳键级为$1.5$,金刚石中碳碳键级为$1$,键级越大,键长越短
"]]石墨中$\rm C$为$\text{s}{{\text{p}}^{\text{2}}}$杂化,金刚石中$\rm C$为$\text{s}{{\text{p}}^{\text{3}}}$杂化,石墨中未参与杂化的$\rm p$轨道相互重叠,形成大$\pi$键$(\pi_{n}^{n}\rm )$,轨道重叠程度变大,键长变短;石墨中有大$\pi$键$(\pi_{n}^{n}\rm )$,碳碳键级为$\rm 1.5$,金刚石中碳碳键级为$\rm 1$,键级越大,键长越短。
| 化学平衡常数题目答案及解析(完整版)
