| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙醇是一种重要的工业原料。请回答:
工业上可采用催化还原$\rm CO_{2}$的方法制备$\rm C_{2}H_{5}OH$,一定温度下,在恒容密闭容器中充入一定量的$\rm CO_{2}$和$\rm H_{2}$,在某固体催化剂$\text{X}$的作用下发生如下自发反应:
主反应:$2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+6{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+3{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad \Delta{{H}_{1}}$
副反应$\rm I$:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad \Delta{{H}_{2}}$
副反应Ⅱ:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad \Delta{{H}_{3}}\gt 0$
①若仅考虑主反应与副反应Ⅱ,下列说法不正确的是$(\quad\ \ \ \ )$。
$\rm A$.当$\rm CO$的体积分数不变时体系达到平衡
$\rm B$.升高温度不利于提高醇类的平衡产率
$\rm C$.体系达到平衡后充入少量氦气,内压增大,主反应平衡正移
$\rm D$.增加催化剂$\rm X$的用量,主反应正、逆反应的活化能均减小
②若仅考虑主反应与副反应$\rm I$,对反应体系加热,随着温度升高,平衡产量比值$\left[ \dfrac{n\left(乙醇 \right)}{n\left( 甲醇\right)} \right]$减小,则$ \Delta H_{1}(\quad\ \ \ \ ) \Delta H_{2} ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm CD$;$\\rm \\lt $
"]]①仅考虑主反应与副反应Ⅱ。
$\rm A$.当$\rm CO$的体积分数不变时,正逆反应速率相等,体系达到平衡,$\rm A$正确;
$\rm B$.升高温度,主反应的平衡逆向移动,不利于提高醇类的平衡产率,$\rm B$正确;
$\rm C$.体系达到平衡后充入少量氦气,虽然内压增大,但主反应中各物质的浓度都未发生改变,平衡不发生移动,$\rm C$不正确;
$\rm D$.增加催化剂$\rm X$的用量,主反应正、逆反应的活化能不会发生改变,$\rm D$不正确;
故选:$\rm CD$。
②若仅考虑主反应与副反应$\rm I($正反应都为放热反应$\rm )$,对反应体系加热,随着温度升高,主反应和副反应Ⅰ都逆向移动,平衡产量比值$\left[ \dfrac{n\left(乙醇 \right)}{n\left( 甲醇\right)} \right]$减小,则表明温度升高,对主反应的影响更大,$ \Delta H_{1}\lt \Delta H_{2}$。
乙酸甲酯电化学合成法制乙醇的工艺中,电解质溶液为稀$\rm H_{2}SO_{4}$,阳极通入$\rm H_{2}$,阴极产物为乙醇与甲醇,物质的量比为$\rm 1:1$。写出阴极的电极反应方程式$\rm ($有机物写结构简式$\rm )$ 。
$\\text{C}{{\\text{H}}_{3}}\\text{COOC}{{\\text{H}}_{3}}+4{{\\text{e}}^{-}}+4{{\\text{H}}^{+}}={{\\text{C}}_{2}}{{\\text{H}}_{5}}\\text{OH}+\\text{C}{{\\text{H}}_{3}}\\text{OH}$
"]]乙酸甲酯电化学合成法制乙醇的工艺中,电解质溶液为稀$\rm H_{2}SO_{4}$,阳极通入$\rm H_{2}$,在阴极,$\rm 1\;\rm mol\;\rm CH_{3}COOCH_{3}$得到$\rm 4\;\rm mol\;\rm e^{-}$,生成$\rm 1\;\rm mol\;\rm CH_{3}CH_{2}OH$和$\rm 1\;\rm mol\;\rm CH_{3}OH$,依据得失电子守恒、电荷守恒和元素守恒,可得出阴极的电极反应方程式:$\text{C}{{\text{H}}_{3}}\text{COOC}{{\text{H}}_{3}}+4{{\text{e}}^{-}}+4{{\text{H}}^{+}}={{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}+\text{C}{{\text{H}}_{3}}\text{OH}$。
乙醇与水蒸气通过催化重整制氢的反应如下:
反应$\rm I$:${{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{\text{I}}}\gt 0$
反应Ⅱ:$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_ {\rm II}}\lt 0$
$\rm 100\;\rm kPa$的恒压密闭容器中,恒定量的$\rm C_{2}H_{5}OH(g)$与适量$\rm H_{2}O(g)$发生上述反应,保持$\rm H_{2}$平衡产率为$m\%$不变,体系温度$(T)$与起始水醇比$\left[ \dfrac{n\left( {{\text{H}}_{2}}\text{O} \right)}{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)} \right]$的关系如图中$\rm X$曲线所示,请回答:
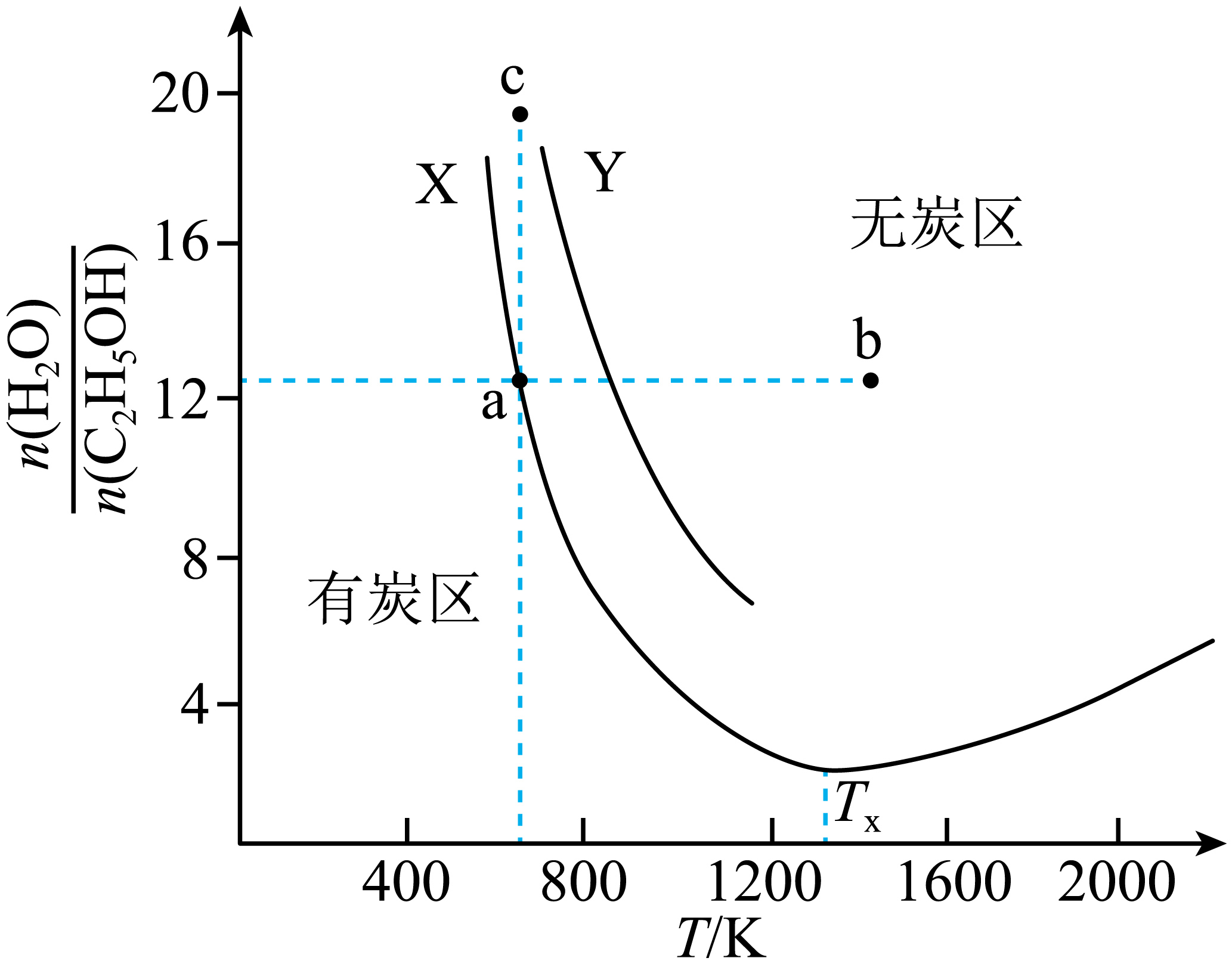
①$\rm H_{2}$的平衡产率:$\rm a$点 $\rm b$点$\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
②反应过程中部分乙醇生成固态炭覆盖催化剂活性位点,降低催化效率,在体系中充入$\rm O_{2}(g)$可除去固态炭。使起始氧醇比$\left[ \dfrac{n\left( {{\text{O}}_{2}} \right)}{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)} \right]\rm =0.5$,保持$\rm H_{2}$平衡产率为$m\%$不变,可得到$\rm Y$曲线$\rm ($部分$\rm )$,将图像划分为有炭区和无炭区,下列判断正确的是 。
$\rm A$.起始氧醇比$\rm =0.5$时,平衡时的反应速率$\rm a$点一定小于$\rm c$点
$\rm B$.反应Ⅱ在图像中$\rm a$、$\rm b$、$\rm c$三点的平衡常数$K_{\mathrm{a}}\lt K_{\mathrm{b}}\lt K_{\mathrm{c}}$
$\rm C$.若使起始氧醇比$\rm =1$,图像中无炭区的面积会更小
$\rm D$.曲线$\rm X$出现拐点的原因是高于$T_{x}$时反应Ⅱ平衡逆移程度大于反应$\rm I$正移
$\\rm \\lt $;$\\rm CD$
"]]①$\rm a$点时,$\rm H_{2}$的平衡产率与曲线上与$\rm b$点相同温度时的$\rm H_{2}$的平衡产率相同,则$\rm b$点相当于曲线上与$\rm b$点同温度的点增大$n\rm (H_{2}O)$,反应Ⅰ、Ⅱ的平衡都发生正向移动,$\rm H_{2}$的产率增大,所以$\rm H_{2}$的平衡产率:$\rm a$点<b点。
②$\rm A$.起始氧醇比$\rm =0.5$时,$\rm a$点与$\rm c$点温度相同,虽然$\rm a$点处于有炭区,但催化剂活性降低程度未知,反应物的浓度大小未知,若其降低程度较小,且$\rm a$点反应物浓度较大,则平衡时的反应速率$\rm a$点不一定小于$\rm c$点,$\rm A$不正确;
$\rm B$.$\rm a$、$\rm c$两点的温度相同,$\rm b$点温度较高,反应Ⅱ的正反应放热,则$\rm b$点$K\rm _{b}$最小,所以在图像中$\rm a$、$\rm b$、$\rm c$三点的平衡常数${{K}_{\text{a}}}={{K}_{\rm c}}\gt {{K}_{\rm b}}$,$\rm B$不正确;
$\rm C$.若使起始氧醇比$\rm =1$,$\rm O_{2}$的量相对增多,更有利于除去固态炭,那么有炭区面积会减小,但$\rm O_{2}$量增多会改变平衡,平衡移动会使一些原本在无炭区的温度$\rm -$起始氧醇比组合,因反应平衡改变而有固态炭生成,即无炭区的边界发生变化,从而导致图像中无炭区的面积会更小,$\rm C$正确;
$\rm D$.在拐点处,$\left[ \dfrac{n\left( {{\text{H}}_{2}}\text{O} \right)}{n\left( {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH} \right)} \right]$增大,表明$\rm H_{2}O$的生成量增多,即反应Ⅱ逆向进行的程度更大,所以曲线$\rm X$出现拐点的原因是高于$T _{x}$时反应Ⅱ平衡逆移程度大于反应$\rm I$正移,$\rm D$正确;
故选:$\rm CD$。
$\rm Al_{2}O_{3}$可做酯化反应的催化剂,乙醇中的氧原子在催化剂表面形成配位键,进而改变键角$\angle \text{COH}$的大小,形成相对稳定的中间体,降低与羧酸反应的活化能。请说明乙醇的键角如何改变,及改变的原因 。
$\\rm Al_{2}O_{3}$中的铝原子与乙醇氧原子的孤对电子形成配位键,降低了氧上孤对电子的电子云密度,孤对电子与$\\text{C}-\\text{O}$、$\\text{H}-\\text{O}$成键电子对之间的排斥力减弱,导致键角$\\angle \\text{COH}$增大
"]]在乙醇分子中,$\rm O$原子的孤电子对数为$\dfrac{6-2}{2}\rm =2$,形成$\rm 2$个$\rm \sigma$键,价层电子数为$\rm 4$,发生$\rm sp^{3}$杂化,$\rm O$原子的孤电子对与$\rm Al_{2}O_{3}$中的$\rm Al$原子形成配位键后,降低了$\rm O$原子上孤电子对的电子云密度,从而降低了对成键电子的排斥力,从而使键角增大。改变的原因:$\rm Al_{2}O_{3}$中的铝原子与乙醇氧原子的孤对电子形成配位键,降低了氧上孤对电子的电子云密度,孤对电子与$\text{C}-\text{O}$、$\text{H}-\text{O}$成键电子对之间的排斥力减弱,导致键角$\angle \text{COH}$增大。
| 化学平衡常数题目答案及解析(完整版)
