| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
“双碳”背景下,以$\text{C}{{\text{O}}_{\text{2}}}$为原料合成$\text{C}{{\text{H}}_{\text{3}}}\text{OH}、{{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$等原料有重要的意义。涉及到的反应如下:
Ⅰ.$\text{C}{{\text{O}}_{\text{2}}}$加氢制甲醇
已知如下热化学方程式:
反应ⅰ:$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=+41.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应ⅱ:$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+3{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-49.4\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应ⅲ:$\text{CO}\left( \text{g} \right)+2{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\quad \Delta {{H}_{\text{3}}}$
计算:$\Delta H_3=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm -90.6$
"]]由盖斯定律可知,反应ⅱ$\rm -$反应ⅰ$\rm =$反应ⅲ,则$\Delta {{H}_{3}}=\Delta {{H}_{2}}-\Delta {{H}_{1}}=\left( -49.4\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)-\left( +41.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)=-90.6\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
维持总压${{p}_{总}}$和投料比$\left[ n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( {{\text{H}}_{\text{2}}} \right)=1:3 \right]$不变,将$\text{C}{{\text{O}}_{\text{2}}}$和${{\text{H}}_{\text{2}}}$混合气以一定流速通过反应器,存在上述三个反应。$\text{C}{{\text{O}}_{\text{2}}}$的转化率$\alpha\left( \text{C}{{\text{O}}_{\text{2}}} \right)$和甲醇的选择性$\chi\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)$温度$T$的变化关系如下图所示。
已知:$\chi\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=\dfrac{转化为甲醇的n\left( \text{C}{{\text{O}}_{\text{2}}} \right)}{消耗的n\left( \text{C}{{\text{O}}_{\text{2}}} \right)}\times 100\%$,忽略温度对催化剂活性造成的影响。
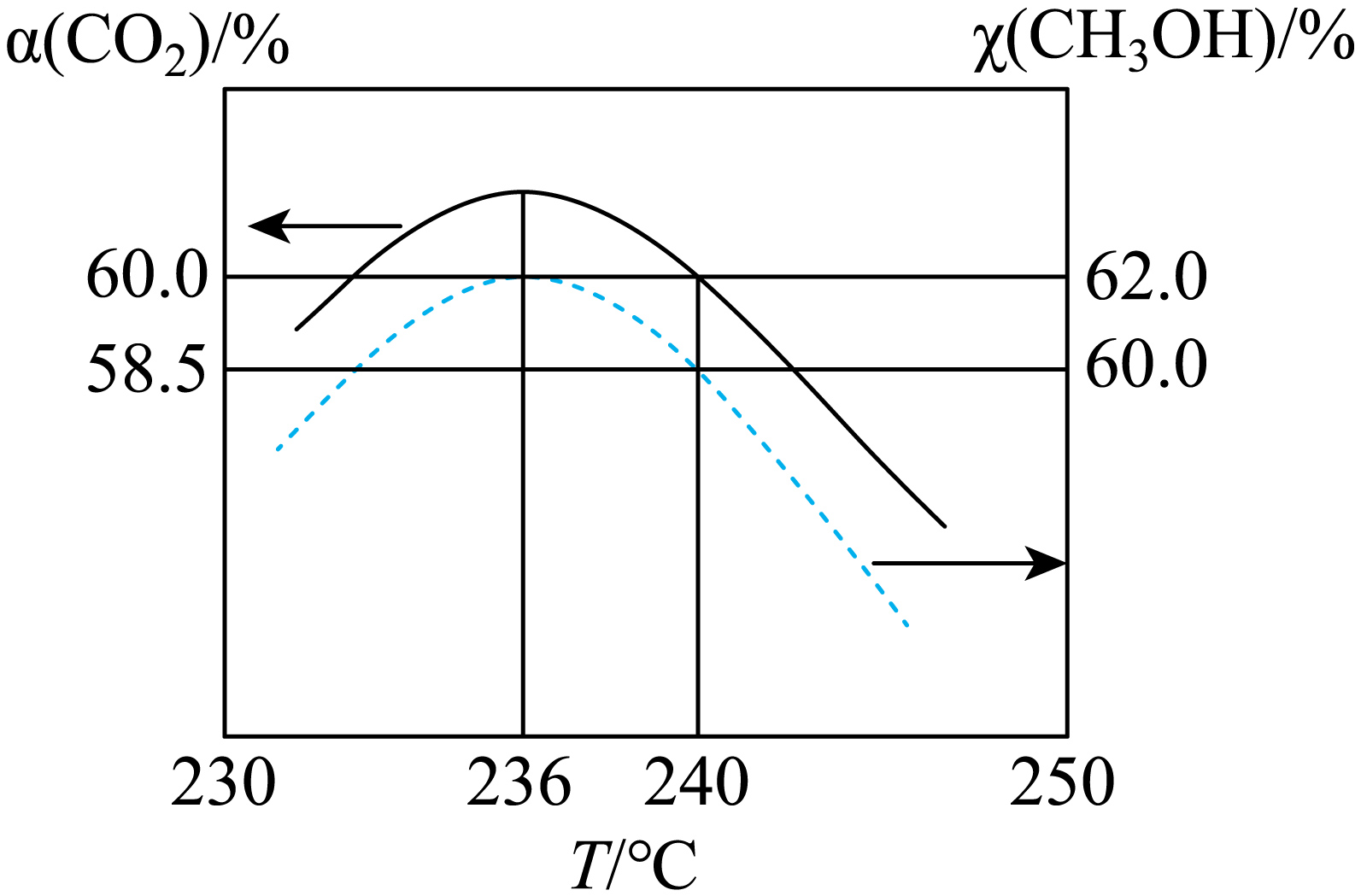
①为同时提高二氧化碳平衡转化率和反应速率,控制的条件合理的是 。
$\rm A$.升高温度 $\rm B$.增大压强
$\rm C$.使用能显著减小反应ⅱ活化能的催化剂 $\rm D$.使用能分离${{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$的分子筛
②当$T\gt 236\ {}^\circ \text{C}$时,甲醇的选择性随温度$\rm T$的增大而减小,可能的原因是 。
③$\rm 240$ $\rm ^\circ\rm C$时,反应ⅰ的${{K}_{\text{p}}}=$ $\rm ($对于气相反应,用某组分$\rm B$的平衡压强$p\left( \text{B} \right)$代替物质的量浓度$c\left( \text{B} \right)$也可表示平衡常数,记作${{K}_{\text{p}}}$,如$p\left( \text{B} \right)=p\cdot x\left( \text{B} \right)$,$\rm p$为平衡总压强,$x\left( \text{B} \right)$为平衡系统中$\rm B$的物质的量分数$\rm )$。
$\\rm B$ ; $\\rm \\gt 236$ $\\rm ^\\circ\\rm C$时,反应ⅰ、ⅱ达到平衡状态;反应ⅰ吸热,温度升高ⅰ平衡正向移动,$\\text{C}{{\\text{O}}_{\\text{2}}}$更多地转化为$\\rm CO$;反应ⅱ放热,温度升高ⅱ平衡逆向移动,$\\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH}$减少,所以甲醇的选择性$\\chi\\left( \\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH} \\right)$随温度$\\rm T$的增大而减小 ; $\\dfrac{3}{14}$
"]]①$\rm A$.升高温度反应速率加快,但反应ⅱ、反应ⅲ逆向移动,不利于提高二氧化碳的转化率,$\rm A$不符合题意;
$\rm B$.增大压强反应速率加快,反应ⅱ、反应ⅲ正向移动,有利于提高二氧化碳的转化率,$\rm B$符合题意;
$\rm C$.使用能显著减小反应ⅱ活化能的催化剂能使反应ⅱ速率加快,但不能改变平衡转化率,不影响提高二氧化碳的转化率,$\rm C$不符合题意;
$\rm D$.使用能分离$\rm H_{2}O$的分子筛会导致$\rm H_{2}O$的浓度减小,反应速率减慢,$\rm D$不符合题意;
故选:$\rm B$。
②大于$\rm 236$ $\rm ^\circ\rm C$时,反应ⅰ、ⅱ达到平衡状态,反应ⅰ吸热,温度升高ⅰ平衡正向移动,$\rm CO_{2}$更多地转化为$\rm CO$;反应ⅱ放热,温度升高ⅱ平衡逆向移动,$\rm CH_{3}OH$减少,综合以上两方面的原因,甲醇的选择性随温度$\rm T$的增大而减小;
③由图知,$\text{240}\ {}^\circ \text{C}$时,$\alpha \text{(C}{{\text{O}}_{\text{2}}}\text{)=60}\text{.0 }\!\!\%$,$\chi \text{(C}{{\text{H}}_{\text{3}}}\text{OH)}=60.0\%$。设起始$n\left( \text{C}{{\text{O}}_{\text{2}}} \right)=1\text{ mol}$,$n\left( {{\text{H}}_{\text{2}}} \right)=3\text{ mol}$,则平衡时$\rm CO_{2}$的物质的量$n\left( \text{C}{{\text{O}}_{\text{2}}} \right)=1\text{ mol}\times \left( 1-60\% \right)=0.4\text{ mol}$,$n\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=1\text{ mol}\times 60\%\times 60\%=0.36\text{ mol}$,则由$\rm C$守恒可得,$n\left( \text{CO} \right)=\left( 1-0.4-0.36 \right)\text{ mol}=0.24\text{ mol}$,由$\rm O$守恒可得,$n\left( {{\text{H}}_{\text{2}}}\text{O} \right)=2\text{ mol}-0.36\text{ mol}-2\times 0.4\text{ mol}-0.24\text{ mol}=0.6\text{ mol}$,由$\rm H$守恒可得,$n\text{(}{{\text{H}}_{\text{2}}}\text{)}=\dfrac{6\text{ mol}-4\times 0.36\text{ mol}-2\times 0.6\text{ mol}}{2}=1.68\text{ mol}$,则总物质的量${{n}_{总}}\text{=0}\text{.4 mol+1}\text{.68 mol+0}\text{.36 mol+0}\text{.6 mol+0}\text{.24 mol = 3}\text{.28 mol}$,$p\left( {{\text{H}}_{\text{2}}} \right)=\dfrac{\text{1}\text{.68 mol}}{\text{3}\text{.28 mol}}\times {{p}_{总}}$,$p\left( \text{C}{{\text{O}}_{\text{2}}} \right)=\dfrac{\text{0}\text{.4 mol}}{\text{3}\text{.28 mol}}\times {{p}_{总}}$,$p\left( \text{CO} \right)=\dfrac{\text{0}\text{.24 mol}}{\text{3}\text{.28 mol}}\times {{p}_{总}}$, $p\left( {{\text{H}}_{\text{2}}}\text{O} \right)=\dfrac{\text{0}\text{.6 mol}}{\text{3}\text{.28 mol}}\times {{p}_{总}}$,${{K}_{\text{p}}}=\dfrac{p(\text{CO})p(\text{H}{}_{\text{2}}\text{O})}{p(\text{C}{{\text{O}}_{\text{2}}})p({{\text{H}}_{2}})}\rm =\dfrac{3}{14}$;
Ⅱ.利用电化学方法通过微生物电催化将$\text{C}{{\text{O}}_{\text{2}}}$有效地转化为,装置如图所示。
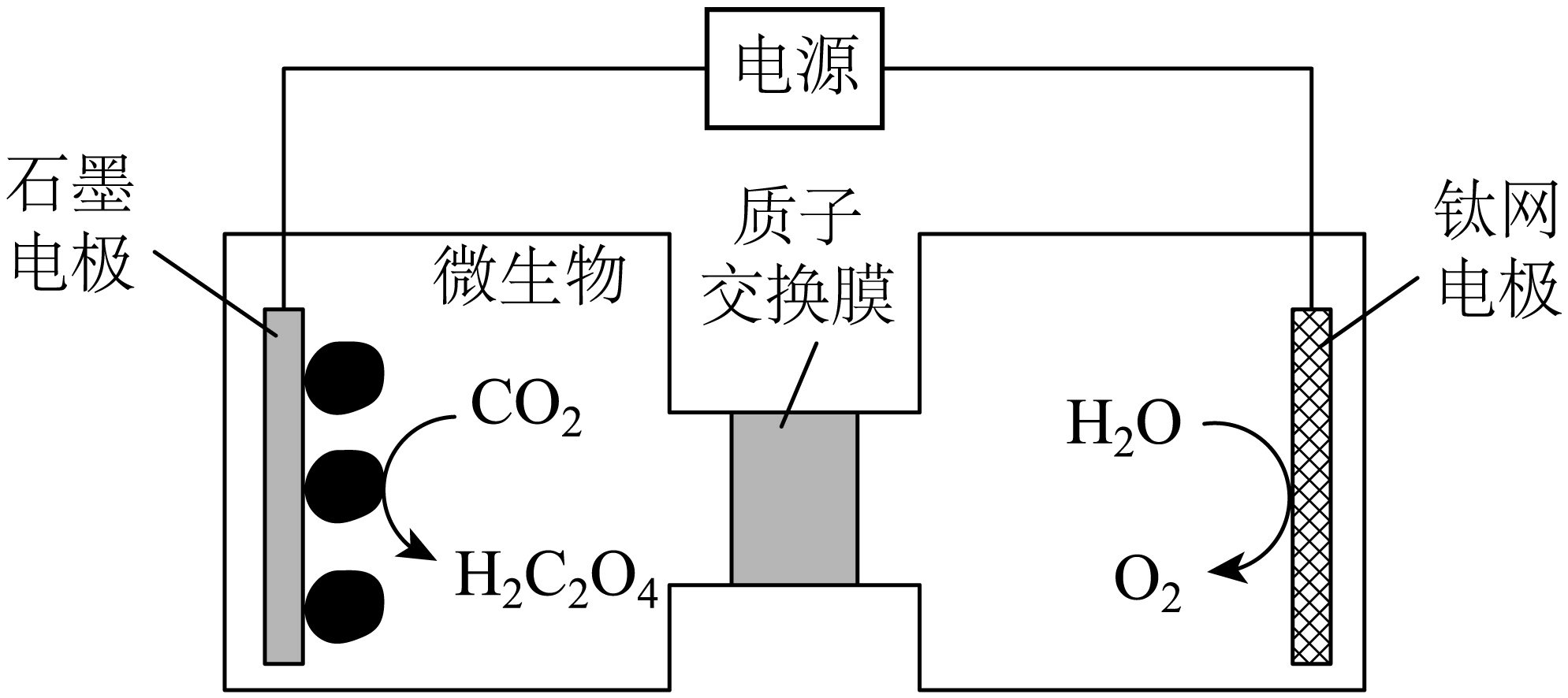
钛网电极是 极$\rm ($填“阳”或“阴”$\rm )$,写出生成${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$的电极反应式 。
阳 ; $\\text{2C}{{\\text{O}}_{\\text{2}}}+2{{\\text{e}}^{-}}+2{{\\text{H}}^{+}}={{\\text{H}}_{\\text{2}}}{{\\text{C}}_{\\text{2}}}{{\\text{O}}_{\\text{4}}}$
"]]由图可知,钛网电极上水放电生成氧气,发生氧化反应,钛网电极为阳极,石墨电极区二氧化碳得到电子发生还原反应生成草酸,电极反应式为$2\text{C}{{\text{O}}_{2}}+2{{\text{e}}^{-}}+2{{\text{H}}^{+}}\overset{{}}{\mathop{=}}\,{{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$;
Ⅲ.一种金属氧化物$\rm ($用$\rm MR$表示$\rm )$催化$\text{C}{{\text{O}}_{\text{2}}}$与环氧丙烷$\rm ($![]() $\rm )$反应制碳酸酯$\rm ($
$\rm )$反应制碳酸酯$\rm ($![]() $\rm )$反应机理如图所示。已知$\text{C}{{\text{O}}_{\text{2}}}$中的碳氧键可以被催化剂中具有较强给电子能力的活性中心的电子进攻而活化断裂。
$\rm )$反应机理如图所示。已知$\text{C}{{\text{O}}_{\text{2}}}$中的碳氧键可以被催化剂中具有较强给电子能力的活性中心的电子进攻而活化断裂。

$\rm MgO$活化催化$\text{C}{{\text{O}}_{\text{2}}}$的能力大于$\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$,试从结构角度分析原因 。
$\\rm Mg$的电负性小于$\\rm Al$;$\\rm MgO$中的$\\rm O$的电子云密度更大,更易进攻活化$\\text{C}{{\\text{O}}_{\\text{2}}}$中的碳氧键
"]]$\rm MgO$活化催化$\rm CO_{2}$的能力强于$\rm Al_{2}O_{3}$的原因是$\rm Mg$的金属性强于$\rm Al$,$\rm MgO$的$\rm O$负电性更强,$\rm MgO$的$\rm O$更易进攻活化$\rm CO_{2}$中的碳氧键。
| 化学平衡常数题目答案及解析(完整版)
