高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
铁元素是生命活动中不可或缺的元素。
无水$\text{FeC}{{\text{l}}_{2}}$晶体的晶胞如图所示,下列说法正确的是$(\quad\ \ \ \ )$。
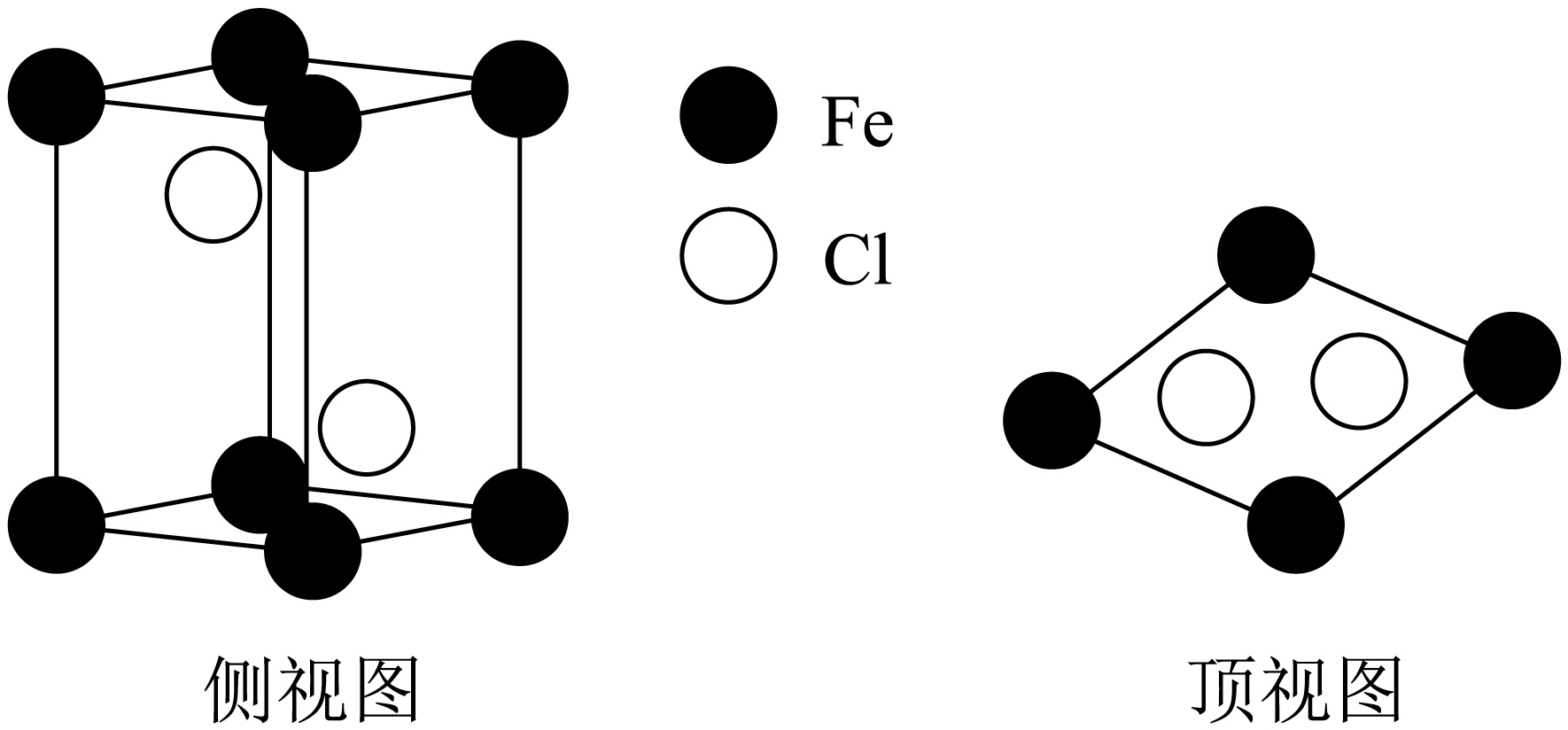
$\\text{Fe}$元素位于周期表第九列
","$\\left[ \\text{Fe}{{\\left( {{\\text{H}}_{2}}\\text{O} \\right)}_{4}} \\right]\\text{C}{{\\text{l}}_{2}}$晶体中的离子键比$\\text{FeC}{{\\text{l}}_{2}}$晶体中的离子键更强
","$\\text{FeC}{{\\text{l}}_{2}}$晶体中存在范德华力
","$\\text{FeC}{{\\text{l}}_{2}}$晶体中$\\text{F}{{\\text{e}}^{{{2+}}}}$离子的配位数为$\\rm 6$
"]$\rm A$.$\text{Fe}$元素的原子序号为$\rm 26$,位于周期表第四周期第八列,$\rm A$错误;
$\rm B$.${{\left[ \text{Fe}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{4}} \right]}^{2+}}$的半径比$\text{F}{{\text{e}}^{2+}}$大,因此$\left[ \text{Fe}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{4}} \right]\text{C}{{\text{l}}_{2}}$晶体中的离子键比$\text{FeC}{{\text{l}}_{2}}$晶体中的离子键弱,$\rm B$错误;
$\rm C$.$\text{FeC}{{\text{l}}_{2}}$中共价键占一定的百分比,因此$\text{FeC}{{\text{l}}_{2}}$晶体存在范德华力,$\rm C$正确;
$\rm D$.由$\text{FeC}{{\text{l}}_{2}}$晶体的晶胞可知,离$\text{F}{{\text{e}}^{{{2+}}}}$最近的$\rm Cl^{-}$的个数为$\rm 6$,因此$\text{FeC}{{\text{l}}_{2}}$晶体中$\text{F}{{\text{e}}^{{{2+}}}}$离子的配位数为$\rm 6$,$\rm D$正确;
故选:$\rm CD$。
①基态$\text{F}{{\text{e}}^{{{3+}}}}$比$\text{F}{{\text{e}}^{{{2+}}}}$更稳定的原因是 。
②$\text{F}{{\text{e}}^{3+}}$和$\text{F}{{\text{e}}^{2+}}$在溶液中都能形成六配位的水合离子,从结构的角度解释,同浓度的$\text{FeC}{{\text{l}}_{3}}$溶液比$\text{FeC}{{\text{l}}_{2}}$溶液酸性更强的原因 。
$\\text{F}{{\\text{e}}^{3+}}$的价层电子排布为$3{{\\text{d}}^{5}}$,是半充满结构,比$\\text{F}{{\\text{e}}^{2+}}$的价层电子排布$3{{\\text{d}}^{6}}$更稳定;$\\text{F}{{\\text{e}}^{3+}}$化合价比$\\text{F}{{\\text{e}}^{2+}}$更高,吸电子比$\\text{F}{{\\text{e}}^{2+}}$更强,使配位的$\\mathrm{O}$的吸引电子能力增强,导致$\\text{O}-\\text{H}$键的极性增强,更易电离出${{\\text{H}}^{+}}$
"]]①基态$\text{F}{{\text{e}}^{3+}}$的价层电子排布为$3{{\text{d}}^{5}}$,是半充满结构,比基态$\text{F}{{\text{e}}^{2+}}$的价层电子排布$3{{\text{d}}^{6}}$更稳定。
②$\text{F}{{\text{e}}^{3+}}$化合价比$\text{F}{{\text{e}}^{2+}}$更高,吸电子能力比$\text{F}{{\text{e}}^{2+}}$更强,使配位的$\mathrm{O}$的吸引电子能力增强,导致$\text{O}-\text{H}$键的极性增强,更易电离出${{\text{H}}^{+}}$,因此同浓度的$\text{FeC}{{\text{l}}_{3}}$溶液比$\text{FeC}{{\text{l}}_{2}}$溶液酸性更强。
某研究小组在隔绝空气的条件下,用$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$混合液制备纯净的纳米$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,实验流程如下:
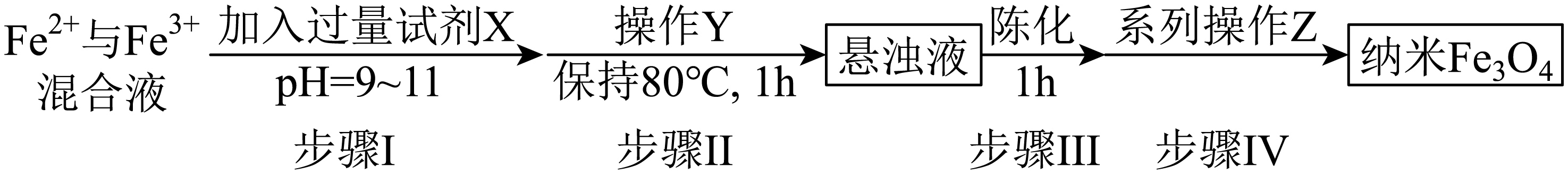
已知:陈化是指将新生成的沉淀在母液中静置一段时间的处理过程,经过陈化可以使固体沉淀颗粒变大。
①试剂$\rm X$的最佳选择是 。
$\rm A$.$\rm \text{NaOH}$ $\rm B$.$\rm \text{NaClO}$ $\rm C$.$\rm \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$ $\rm D$.$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$
②步骤Ⅱ中操作$\rm Y$是 。
③步骤Ⅳ中系列操作$\rm Z$是 。
$\\rm C$;搅拌;过滤,洗涤,干燥
"]]隔绝空气,在$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$混合液中加入过量氨水,使得$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$完全转化为$\text{Fe(OH}{{\text{)}}_{\text{2}}}$与$\text{Fe(OH}{{\text{)}}_{\text{3}}}$沉淀,搅拌悬浊液并加热,使得悬浊液转化为$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,陈化使固体沉淀颗粒变大,再过滤、洗涤、干燥制得纯净的纳米$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$。
①加入过量试剂$\rm X$,使得$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$完全转化为$\text{Fe(OH}{{\text{)}}_{\text{2}}}$与$\text{Fe(OH}{{\text{)}}_{\text{3}}}$沉淀,故试剂$\rm X$应为碱溶液,而过量的$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$在加热时易分解挥发从而可以除去,因此试剂$\rm X$的最佳选择是$\rm C$。
②根据分析,在$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$混合液中加入过量氨水,使得$\text{F}{{\text{e}}^{{{2+}}}}$与$\text{F}{{\text{e}}^{{{3+}}}}$完全转化为沉淀,搅拌悬浊液并加热,使得悬浊液转化为$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,因此步骤Ⅱ中操作$\rm Y$是搅拌。
③根据分析,悬浊液经过陈化得到纳米$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,再经过过滤、洗涤、干燥制得纯净的纳米$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,因此步骤Ⅳ中系列操作$\rm Z$是过滤、洗涤、干燥。
邻二氮菲$\rm ($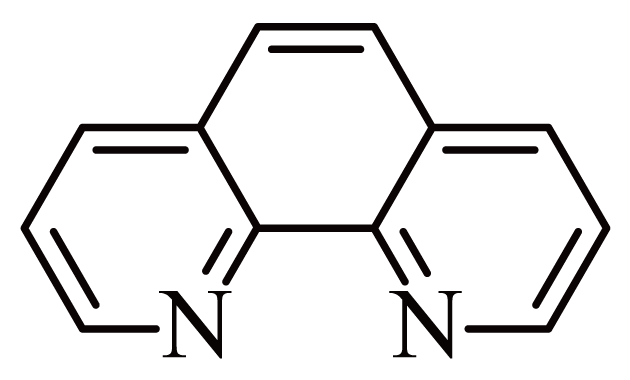 $\rm )($用$\rm R$表示$\rm )$中$\rm N$原子可与$\text{F}{{\text{e}}^{{{2+}}}}$形成橙红色的配离子${{\left[ \text{Fe}{{\text{R}}_{3}} \right]}^{{{2+}}}}$,${{\left[ \text{Fe}{{\text{R}}_{3}} \right]}^{{{2+}}}}$对特定波长光的吸收程度$\rm ($用吸光度$\rm A$表示$\rm )$与$\text{F}{{\text{e}}^{{{2+}}}}$在一定浓度范围内成正比,利用该反应可测定$\text{F}{{\text{e}}^{{{2+}}}}$浓度。$\rm R$中氮原子的杂化方式为 ;测定的过程中首先要加入盐酸羟胺$\left( \text{N}{{\text{H}}_{2}}\text{OH}\cdot \text{HCl} \right)$除去溶液中的$\text{F}{{\text{e}}^{{{3+}}}}$,请写出该反应的离子方程式 ;然后调节溶液的$\text{pH}$范围为$\rm 2\sim 9$,加入$\text{R}$,开展测定实验。请解释选择该$\text{pH}$范围的原因 。
$\rm )($用$\rm R$表示$\rm )$中$\rm N$原子可与$\text{F}{{\text{e}}^{{{2+}}}}$形成橙红色的配离子${{\left[ \text{Fe}{{\text{R}}_{3}} \right]}^{{{2+}}}}$,${{\left[ \text{Fe}{{\text{R}}_{3}} \right]}^{{{2+}}}}$对特定波长光的吸收程度$\rm ($用吸光度$\rm A$表示$\rm )$与$\text{F}{{\text{e}}^{{{2+}}}}$在一定浓度范围内成正比,利用该反应可测定$\text{F}{{\text{e}}^{{{2+}}}}$浓度。$\rm R$中氮原子的杂化方式为 ;测定的过程中首先要加入盐酸羟胺$\left( \text{N}{{\text{H}}_{2}}\text{OH}\cdot \text{HCl} \right)$除去溶液中的$\text{F}{{\text{e}}^{{{3+}}}}$,请写出该反应的离子方程式 ;然后调节溶液的$\text{pH}$范围为$\rm 2\sim 9$,加入$\text{R}$,开展测定实验。请解释选择该$\text{pH}$范围的原因 。
$\\mathrm{sp}^2$;$2\\text{F}{{\\text{e}}^{3+}}+2\\text{N}{{\\text{H}}_{3}}\\text{O}{{\\text{H}}^{+}}=2\\text{F}{{\\text{e}}^{2+}}+{{\\text{N}}_{2}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}+4{{\\text{H}}^{+}}$;当${{\\text{H}}^{+}}$浓度高时,邻二氮菲中的$\\text{N}$优先与${{\\text{H}}^{+}}$形成配位键,导致与$\\text{F}{{\\text{e}}^{2+}}$配位能力减弱;若$\\text{O}{{\\text{H}}^{-}}$浓度较高时,$\\text{O}{{\\text{H}}^{-}}$与$\\text{F}{{\\text{e}}^{{{2+}}}}$反应,也会影响与邻二氮菲配位
"]]根据图示可知,氮原子形成了$\rm 2$个$\rm \sigma$键,$\rm 1$对孤电子对,$\rm 1$个$\rm \pi$键,氮原子的杂化方式为$\mathrm{sp}^2$;$\text{F}{{\text{e}}^{3+}}$与盐酸羟胺$\left( \text{N}{{\text{H}}_{2}}\text{OH}\cdot \text{HCl} \right)$反应生成$\text{F}{{\text{e}}^{\text{2+}}}$与氮气,该反应的离子方程式为$2\text{F}{{\text{e}}^{3+}}+2\text{N}{{\text{H}}_{3}}\text{O}{{\text{H}}^{+}}=2\text{F}{{\text{e}}^{2+}}+{{\text{N}}_{2}}\uparrow +2{{\text{H}}_{2}}\text{O}+4{{\text{H}}^{+}}$;当${{\text{H}}^{+}}$浓度高时,邻二氮菲中的$\text{N}$优先与${{\text{H}}^{+}}$形成配位键,导致与$\text{F}{{\text{e}}^{2+}}$配位能力减弱;若$\text{O}{{\text{H}}^{-}}$浓度较高时,$\text{O}{{\text{H}}^{-}}$与$\text{F}{{\text{e}}^{{{2+}}}}$反应,也会影响与邻二氮菲配位,因此需调节溶液的$\text{pH}$范围为$\rm 2\sim 9$。
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
