高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
碳元素具有丰富的化学性质,碳及其化合物有着广泛的应用。
$^{13}\text{C}-\text{NMR}$能测定含碳化合物的骨架结构。在基态$^{13}\text{C}$原子中,核外存在 对自旋相反的电子。
$\\rm 2$
"]]基态$^{13}\text{C}$原子核外有$\rm 6$个电子,电子排布式为$\rm 1s^{2}2s^{2}2p^{2}$,核外存在$\rm 2$对自旋相反的电子;
我国科学家利用$\text{CC}{{\text{l}}_{4}}$与$\text{Na}$、$\text{Mg}$等活泼金属反应合成了金刚石,为金刚石的合成提供了重要的研究思路。
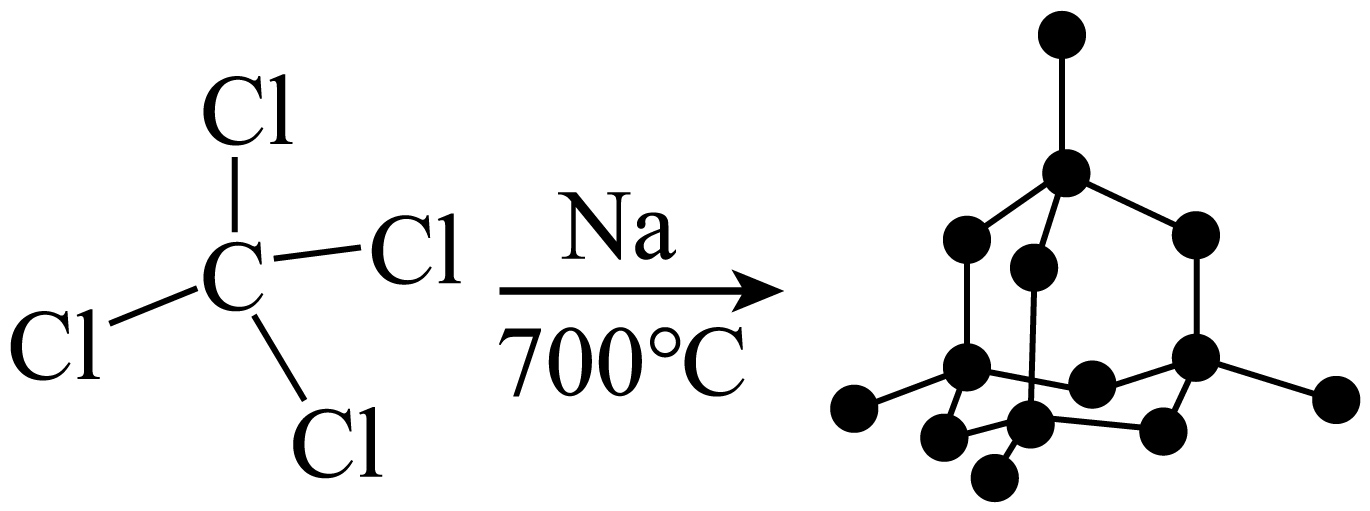
①$\text{Cl}$、$\text{Na}$、$\text{Mg}$第一电离能由大到小的顺序为 。
②$\text{CC}{{\text{l}}_{4}}$的$\text{C}-\text{Cl}$键是由碳的 轨道与氯的$\text{3p}$轨道重叠形成$\sigma$键。
$\\text{Cl}\\gt \\text{Mg}\\gt \\text{Na}$;$\\rm 1$个$\\text{s}{{\\text{p}}^{3}}$杂化
"]]①同周期从左到右第一电离能有增大趋势,故第一电离能$\rm Cl\gt Mg\gt Na$;
②$\rm CCl_{4}$的中心原子为$\rm C$,价层电子对数为$\rm 4+\dfrac{4-4\times 1}{2}=4$,孤电子对为$\rm 0$,杂化方式为$\rm sp^{3}$杂化,$\rm C- Cl$键是由碳的$\rm 1$个$\rm sp^{3}$杂化轨道与氯的$\rm 3p$轨道重叠形成$\rm \sigma$键;
早期以石墨为原料在高温高压条件下合成金刚石。图$\rm a$为金刚石晶胞,图$\rm b$为石墨的层状结构$\rm ($虚线所示部分为其晶胞,如图$\rm c$所示$\rm )$。
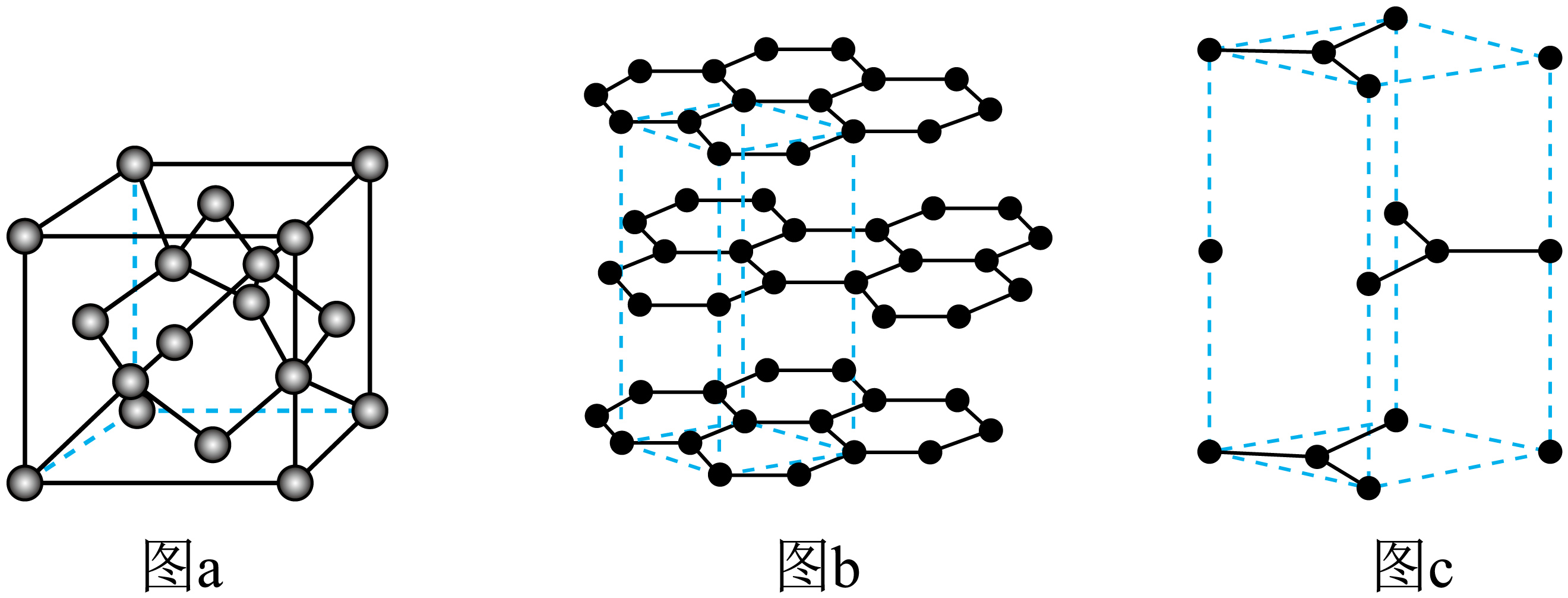
①石墨晶胞所含碳原子数为 。
②金刚石的密度为$\rho\;\rm { g}/{c}{{{m}}^{3}}$,晶胞形状为立方体,边长为${a\;\rm nm}\left( 1\;\rm {nm}={{10}^{-7}}\;\rm {cm} \right)$,阿伏加德罗常数的值为 $\rm ($用含$\rho$,${ a}$的关系式表示$\rm )$。
$\\rm 4$ $\\dfrac{96}{\\rho\\cdot {{\\left( {a}\\times {{10}^{-7}} \\right)}^{3}}}$
"]]①图$c$为石墨的晶胞,内部有$\rm 1$个$\rm C$原子,面上有$\rm 2$个$\rm C$原子,棱上有$\rm 4$个$\rm C$原子,顶角有$\rm 8$个$\rm C$原子,$\rm C$原子个数为$\rm 1+2\times \dfrac{1}{2}+4\times \dfrac{1}{6}+4\times \dfrac{1}{12}+2\times \dfrac{1}{3}+2\times \dfrac{1}{6}=4$;
②金刚石晶胞中$\rm C$原子数为$\rm 4+8\times \dfrac{1}{8}\rm +6\times \dfrac{1}{2}\rm =8$,质量为$\dfrac{8\times 12}{{{{N}}_{\rm {A}}}}\rm \;{g}$,体积为$ (a\times 10^{-7})^{3}\;\rm cm^{3}$,根据密度公式$\rho=\dfrac{{m}}{{V}}=\dfrac{\dfrac{8\times 12}{{{{N}}_{\rm {A}}}}}{{{({a}\times {{10}^{-7}})}^{3}}}$,$ N_{\rm A}=\dfrac{96}{\rho\cdot {{\left( {a}\times {{10}^{-7}} \right)}^{3}}}$;
碳在物质转化中起着重要作用。$\text{Si}{{\text{O}}_{2}}$与$\text{C}{{\text{l}}_{2}}$较难发生反应:$\text{Si}{{\text{O}}_{2}}(\text{s})+2\text{C}{{\text{l}}_{2}}(\text{g})=\text{SiC}{{\text{l}}_{4}}(\text{g})+{{\text{O}}_{2}}(\text{g})\qquad \Delta {H}\gt 0$,加碳生成$\text{CO}$可使反应得以进行。解释加碳反应更易进行的原因: 。
$\\rm C$和${{\\text{O}}_{2}}$生成$\\text{CO}$并放热,使$\\text{Si}{{\\text{O}}_{2}}+2\\text{C}{{\\text{l}}_{2}}+2\\text{C}=\\text{SiC}{{\\text{l}}_{6}}+2\\text{CO}$反应趋势变大$\\rm ($碳与${{\\text{O}}_{2}}$反应生成$\\text{CO}$放出热量,使体系温度升高,同时降低$ {c}\\left( {{\\text{O}}_{2}} \\right)$,均促进反应正向进行$\\rm )$
"]]$\text{Si}{{\text{O}}_{2}}(\text{s})+2\text{C}{{\text{l}}_{2}}(\text{g})=\text{SiC}{{\text{l}}_{4}}(\text{g})+{{\text{O}}_{2}}(\text{g})\qquad \Delta {H}\gt 0$,$\Delta S\lt 0$,反应难以自发进行,加碳生成$\rm CO$,放出热量,使温度升高,总反应$\text{Si}{{\text{O}}_{2}}+2\text{C}{{\text{l}}_{2}}+2\text{C}=\text{SiC}{{\text{l}}_{6}}+2\text{CO}$趋势变大,同时消耗了$\rm O_{2}$,使平衡正向进行。
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
