高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
废旧钴酸锂电池负极材料含碳单质,正极材料主要成分为$\rm LiCoO_{2}$、并含少量$\rm Ni$、$\rm Cu$、$\rm Fe$等金属元素,未经处理随意丢弃容易导致污染,回收利用可以变废为宝。一种利用废旧锂离子电池正极材料回收锂和钴的工艺流程如下:
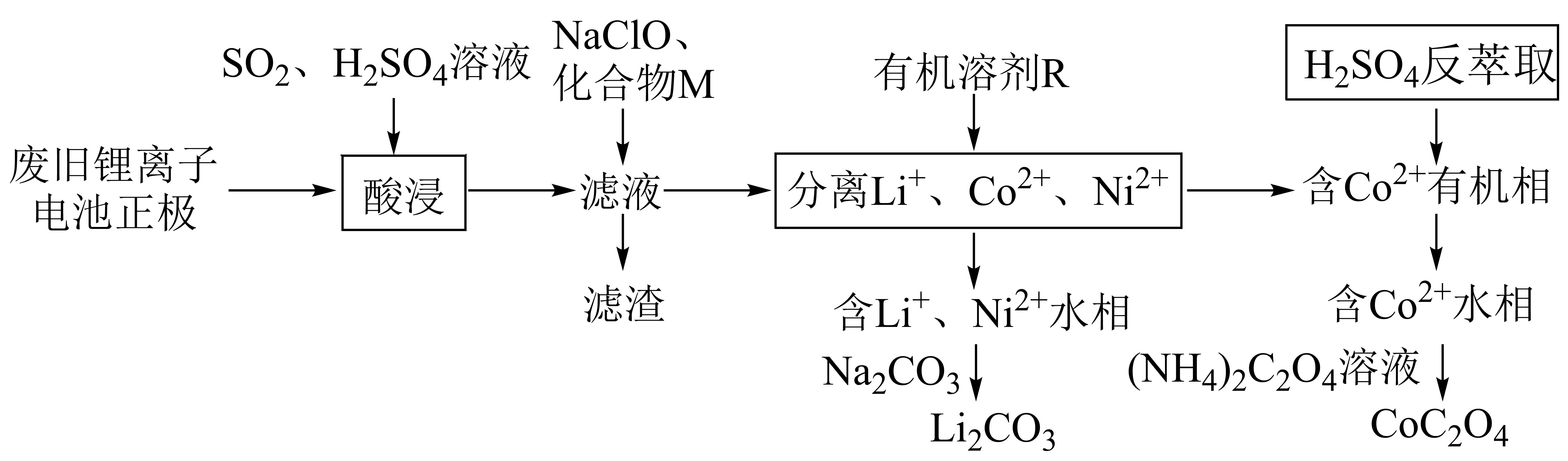
已知:①$\rm Co^{3+}$具有强氧化性,能将水中的$\text{C}{{\text{l}}^{-}}$氧化成$\text{C}{{\text{l}}_{\text{2}}}$;
②常温下,有关金属离子形成氢氧化物沉淀的相关$\text{pH}$见下表:
| 离子 | $\rm Co^{2+}$ | $\rm Ni^{2+}$ | $\rm Fe^{2+}$ | $\rm Fe^{3+}$ | $\rm Cu^{2+}$ |
| 开始沉淀时的$\rm pH$ | $\rm 6.7$ | $\rm 6.8$ | $\rm 6.2$ | $\rm 1.9$ | $\rm 4.4$ |
| 沉淀完全时的$\rm pH$ | $\rm 9.3$ | $\rm 8.8$ | $\rm 8.3$ | $\rm 3.3$ | $\rm 6.5$ |
某激发态$\rm Li$原子的电子排布式为$\rm 1s^{1}2s^{1}2p^{1}$,该原子最高能级的电子可能有 种运动状态,该原子的电子排布违背了 。
$\rm A$.能量最低原理 $\rm B$.泡利不相容原理 $\rm C$.洪特规则
$\\rm 6$ ; $\\rm A$
"]]激发态$\rm Li$原子的最高能级电子在$\rm 2p$能级,该能级有$\rm 3$个原子轨道,每个轨道可容纳两个自旋方向相反的电子,故该原子最高能级的电子可能有$\rm 6$种运动状态;该排布不是基态,显然违背了“能量最低原理”。
酸浸过程中,$\text{S}{{\text{O}}_{\text{2}}}$的作用是 。废旧电池“放电处理”有利于该工艺$\text{Li}$的回收,其原因是 。
将$\\text{C}{{\\text{o}}^{\\text{3+}}}$还原为$\\text{C}{{\\text{o}}^{\\text{2+}}}$ ; 放电有利于$\\rm Li^{+}$从负极经电解液进入正极材料中
"]]$\rm LiCoO_{2}$中$\rm Co$的化合价为$\rm +3$价,酸浸后变成$\rm +2$价,是$\text{S}{{\text{O}}_{2}}$将其还原了。根据锂离子电池放电反应为$\text{L}{{\text{i}}_{1-x}}\text{Co}{{\text{O}}_{2}}+\text{L}{{\text{i}}_{x}}\text{C}=\text{LiCo}{{\text{O}}_{\text{2}}}+\text{C}$可知,放电时,正极反应为:$\text{L}{{\text{i}}_{1-x}}\text{Co}{{\text{O}}_{2}}+x\text{L}{{\text{i}}^{+}}+x{{\text{e}}^{-}}=\text{LiCo}{{\text{O}}_{\text{2}}}$,放电有利于锂离子尽快转移到正极,有利于锂的回收。
加入适量$\text{NaClO}$溶液后测得溶液$\text{pH}$为$\rm 1.8$,用离子方程式表示加入$\text{NaClO}$溶液的作用 。化合物$\rm M$的作用是调节$\text{pH}$,应将$\text{pH}$调节到 的范围内。
$\\text{2F}{{\\text{e}}^{\\text{2+}}}\\text{+Cl}{{\\text{O}}^{-}}\\text{+2}{{\\text{H}}^{+}}\\text{=2F}{{\\text{e}}^{\\text{3+}}}\\text{+C}{{\\text{l}}^{-}}+{{\\text{H}}_{\\text{2}}}\\text{O}$ ; $\\text{6}\\text{.5}\\le {\\rm pH}\\lt 6\\text{.7}$
"]]根据题意,滤渣应将$\rm Fe$和$\rm Cu$元素除去,且不沉淀$\text{C}{{\text{o}}^{2+}}$和$\text{N}{{\text{i}}^{2+}}$,根据表格$\text{F}{{\text{e}}^{\text{2}}}^{+}$是不容易与$\text{C}{{\text{o}}^{2+}}$和$\text{N}{{\text{i}}^{2+}}$分离的,应将$\text{F}{{\text{e}}^{\text{2}}}^{+}$氧化为$\text{F}{{\text{e}}^{\text{3}}}^{+}$除去,$\text{NaClO}$有氧化性,能达到该目的,离子方程式为:$\text{2F}{{\text{e}}^{\text{2+}}}\text{+Cl}{{\text{O}}^{-}}\text{+2}{{\text{H}}^{+}}\text{=2F}{{\text{e}}^{\text{3+}}}\text{+C}{{\text{l}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}$。根据题干表格数据,要将$\text{F}{{\text{e}}^{\text{3}}}^{+}$和$\text{C}{{\text{u}}^{\text{2}}}^{+}$沉淀完全,$\rm pH≥ 6.5$;$\text{C}{{\text{o}}^{2+}}$不能沉淀,$\rm pH\lt 6.7$,所以$\rm pH$的调整范围是 $\text{6}\text{.5}\le {\rm pH}\lt 6\text{.7}$。
$\text{C}{{\text{o}}^{\text{2+}}}$水相加入${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$溶液后,过滤得到$\text{Co}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$固体,滤液中溶质可做化工原料,写出该原料的一种用途 。
生产氮肥
"]]根据分析可知,滤液中溶质为${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$,含$\rm N$元素,故可用来生产化肥。
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
