高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
锌$\rm -$溴可充电电池具有长循环寿命、高安全性、低成本和广泛可用的活性材料等特点。以下为一种液流有膜锌$\rm -$溴电池装置,其中电解液为溴化锌溶液。
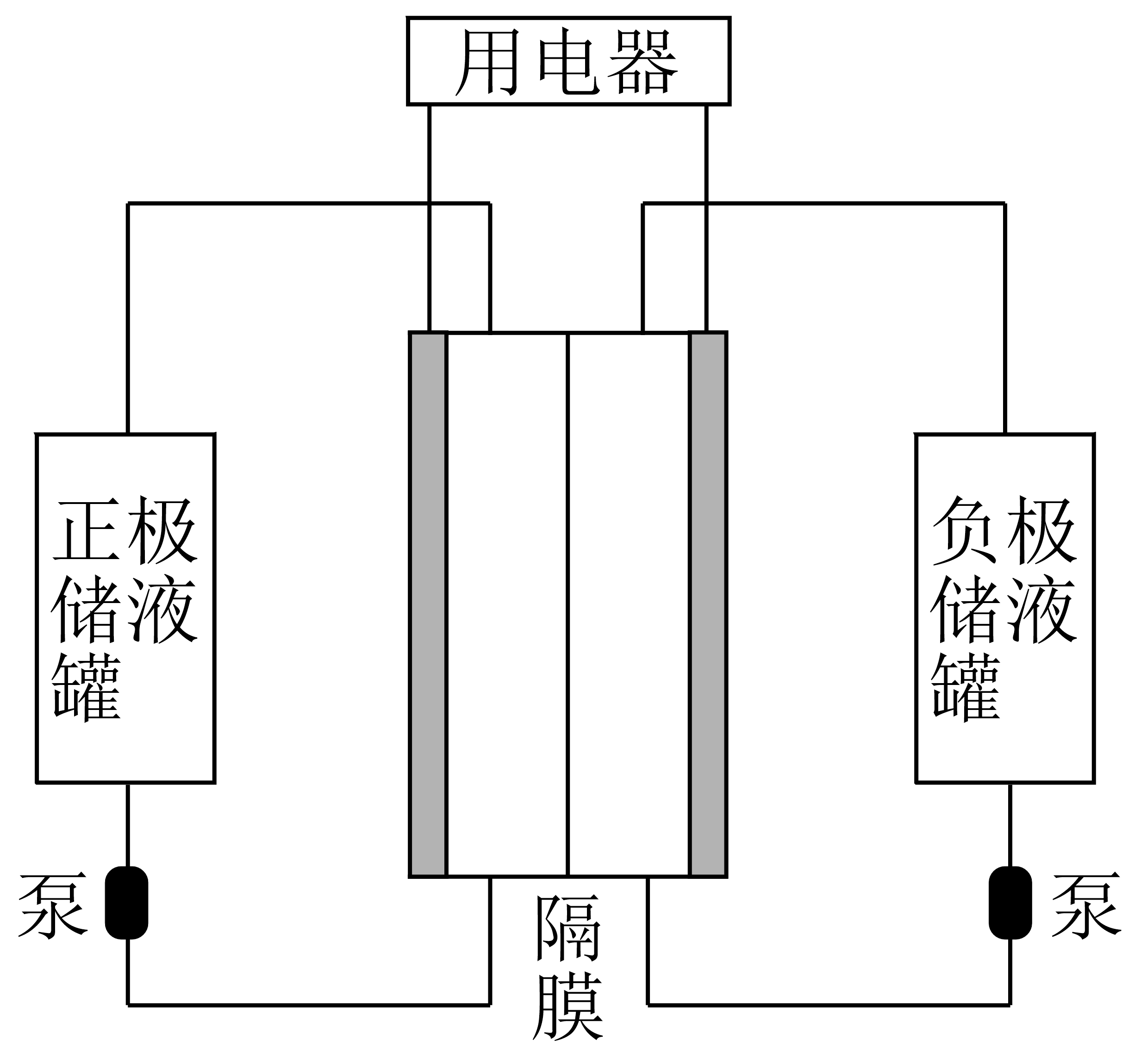
写出以上装置负极电极反应 。
$\\text{Zn - 2}{{\\text{e}}^{-}}=\\text{Z}{{\\text{n}}^{2+}}$
"]]锌$\rm -$溴可充电电池装置活泼的为负极,负极为锌,电极反应$\text{Zn - 2}{{\text{e}}^{-}}=\text{Z}{{\text{n}}^{2+}}$;
锌溴电池电解液中一般需要添加电解质增强其导电性,以下能作为添加剂的是 。
$\rm A$.$\rm FeCl_{3}$ $\rm B$.$\rm AgNO_{3}$ $\rm C$.乙醇 $\rm D$.$\rm KCl$
$\\rm D$
"]]$\rm A$.$\rm FeCl_{3}$会与$\rm Zn$发生氧化还原反应,$\rm \text{2F}{{\text{e}}^{\text{3+}}}\text{+Zn=Z}{{\text{n}}^{\text{2+}}}\text{+2F}{{\text{e}}^{\text{2+}}}$,$\rm A$错误;
$\rm B$.$\rm AgNO_{3}$会与$\rm \text{B}{{\text{r}}^{-}}$形成沉淀,$\rm Ag^{+}+Br^{-}=AgBr\downarrow$,$\rm B$错误;
$\rm C$.乙醇为非电解质,不能增强导电性,$\rm C$错误;
$\rm D$.$\rm KCl$本身不参与电源中的反应,且为电解质,可增强其导电性,$\rm D$正确;
故选:$\rm D$;
充电过程中,生成的$\rm Br_{2}$易与溶液中$\rm Br$ $\rm ^{-}$反应生成多溴离子$(\text{Br}_{3}^{-}$、$\text{Br}_{5}^{-}$等$\rm )$,与负极上的锌反应,造成严重的自放电行为,影响电池效果。为了解决这个问题,可以在电解液中加入$\rm Br$ $\rm ^{-}$络合剂$\rm MEP($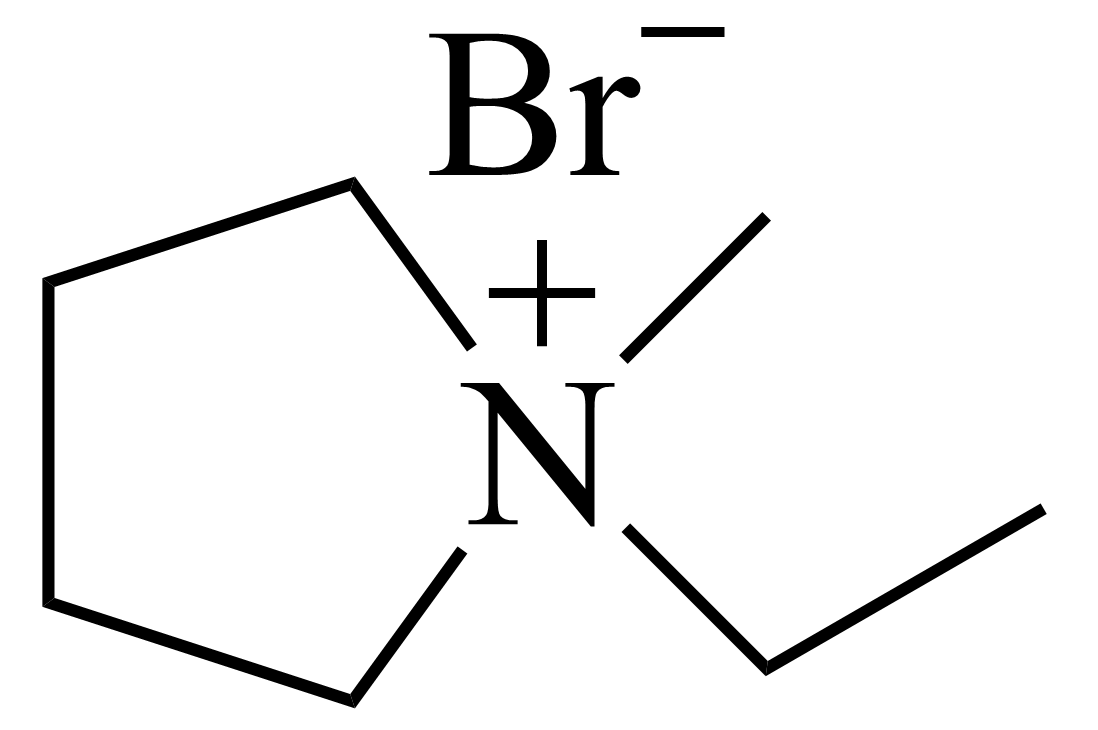 $\rm )$。
$\rm )$。
充电过程中,在 生成$\rm Br_{2}$。
$\rm A$.正极 $\rm B$.负极 $\rm C$.阳极 $\rm D$.阴极
$\\rm C$
"]]充电过程中,阳极失电子,电极反应为$\rm \text{2B}{{\text{r}}^{-}}\text{-2}{{\text{e}}^{-}}\text{=B}{{\text{r}}_{\text{2}}}$,故选:$\rm C$;
关于$\rm MEP$说法正确的是 。
$\rm A$.$\rm MEP$属于共价化合物
$\rm B$.$\rm MEP$中仅存在极性共价键
$\rm C$.$\rm MEP$中$\rm C$、$\rm N$原子杂化方式均为$\rm sp^{3}$
$\rm D$.$\rm MEP$中部分元素第一电离能大小为:$\rm C\gt N$
$\\rm C$
"]]$\rm A$.$\rm MEP($ $\rm )$中含阴阳离子,属于离子化合物,$\rm A$错误;
$\rm )$中含阴阳离子,属于离子化合物,$\rm A$错误;
$\rm B$.$\rm MEP$中非极性共价键$\rm (C-C$键$\rm )$和极性共价键$\rm (C-H$、$\rm C-N$键$\rm )$,$\rm B$错误;
$\rm C$.$\rm MEP$中$\rm C$的价层电子对数为$\rm 4+\dfrac{4-1\times 4}{2}=4$、$\rm N$原子的价层电子对数为$\rm 4+\dfrac{5-1-1\times 4}{2}=4$,杂化方式均为$\rm sp^{3}$,$\rm C$正确;
$\rm D$.同周期第一电离能随原子序数的增大,第Ⅱ$\rm A$族,第Ⅴ$\rm A$族大于相邻元素,故第一电离能大小为:$\rm C\lt N$,$\rm D$错误;
比较$\rm C$与$\rm N$元素电负性大小,且列举一个事实证明 。
电负性$\\rm N\\gt C$,硝酸的酸性强于碳酸;氮化碳中氮的化合价为负价,碳为正价;碳酸氢钠和硝酸反应生成二氧化碳;硝酸钠溶液呈中性,碳酸钠溶液呈碱性
"]]同周期电负性从左向右依次增大,电负性$\rm N\gt C$,例如:硝酸的酸性强于碳酸;氮化碳中氮的化合价为负价,碳为正价;碳酸氢钠和硝酸反应生成二氧化碳;硝酸钠溶液呈中性,碳酸钠溶液呈碱性;
$\rm Br$元素在元素周期表中的位置为 。
第$\\rm 4$周期第Ⅶ$\\rm A$族$\\rm ($第$\\rm 17$族$\\rm )$
"]]$\rm Br$是第$\rm 35$号元素,核外电子排布为$\rm 2$、$\rm 8$、$\rm 18$、$\rm 7$,元素在元素周期表中的位置为第$\rm 4$周期第Ⅶ$\rm A$族$\rm ($第$\rm 17$族$\rm )$;
部分卤化锌的熔点如下:
| 物质 | $\rm ZnF_{2}$ | $\rm ZnCl_{2}$ | $\rm ZnBr_{2}$ | $\rm ZnI_{2}$ |
| 熔点 | $\rm 872 \ {}^\circ \text{C}$ | $\rm 293 \ {}^\circ \text{C}$ | $\rm 394 \ {}^\circ \text{C}$ | $\rm 445 \ {}^\circ \text{C}$ |
解释以上卤化锌熔点变化规律 。
$\\rm ZnF_{2}$为离子晶体,熔化克服离子键,$\\rm ZnCl_{2}$ 、$\\rm ZnBr_{2}$ 、$\\rm ZnI_{2}$为分子晶体,熔化克服范德华力,一般离子键强于范德华力,所以$\\rm ZnF_{2}$熔点最高。$\\rm ZnCl_{2}$ 、$\\rm ZnBr_{2}$ 、$\\rm ZnI_{2}$结构相似,相对分子质量依次增大,范德华力依次增大,熔点依次增大
"]]$\rm ZnF_{2}$的熔点远高于其它三种卤化锌,其原因是$\rm ZnF_{2}$为离子晶体,熔化克服离子键,$\rm ZnCl_{2}$ 、$\rm ZnBr_{2}$ 、$\rm ZnI_{2}$为分子晶体,熔化克服范德华力,一般离子键强于范德华力,所以$\rm ZnF_{2}$熔点最高。$\rm ZnCl_{2}$ 、$\rm ZnBr_{2}$ 、$\rm ZnI_{2}$结构相似,相对分子质量依次增大,范德华力依次增大,熔点依次增大;
$\rm Zn^{2+}$的沉积过程中受多种因素影响,容易形成锌枝晶$\rm ($树状金属锌$\rm )$。电解质中$\rm [Zn(H_{2}O)_{4}]^{2+}$的去溶剂$\rm (H_{2}O)$化能比较高,未脱除的水分子会优先得电子,是易形成锌枝晶的因素之一。
判断是否产生锌枝晶最有效的方法为 。
$\rm A$.原子吸收光谱 $\rm B$.红外光谱
$\rm C$.核磁共振氢谱 $\rm D$.晶体$\rm X$射线衍射
$\\rm D$
"]]锌枝晶属于金属晶体,测定晶体最可靠的科学方法是进行$\rm X$射线衍射实验;
$\rm [Zn(H_{2}O)_{4}]^{2+}$的中心离子的价层电子排布式为 ,去溶剂$\rm (H_{2}O)$化过程中需要克服的化学键为 。$\rm ($不定项$\rm )$
$\rm A$.离子键 $\rm B$.范德华力 $\rm C$.氢键 $\rm D$.配位键
$\\rm 3d^{10}$ ; $\\rm D$
"]]$\rm [Zn(H_{2}O)_{4}]^{2+}$的中心离子为$\rm Zn^{2+}$,$\rm Zn$是第$\rm 30$号元素,价层电子排布式为$\rm 3d^{10}4s^{2}$,$\rm Zn^{2+}$价层电子排布式为$\rm 3d^{10}$,$\rm [Zn(H_{2}O)_{4}]^{2+}$中,水和$\rm Zn^{2+}$以配位键结合,故去溶剂$\rm (H_{2}O)$化过程中需要克服的化学键为配位键,故选: $\rm D$。
高中 | 原电池工作原理题目答案及解析(完整版)
