高中 | 离子化合物 题目答案及解析
稿件来源:高途
高中 | 离子化合物题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
离子化合物
科学家利用四种原子序数依次递增的短周期元素$\rm W$、$\rm X$、$\rm Y$、$\rm Z$“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,实线代表共价键,其他重复单元的$\rm W$、$\rm X$未标注。$\rm W$、$\rm X$、$\rm Z$分别位于不同周期,$\rm Z$是同周期中金属性最强的元素。下列说法正确的是$(\quad\ \ \ \ )$
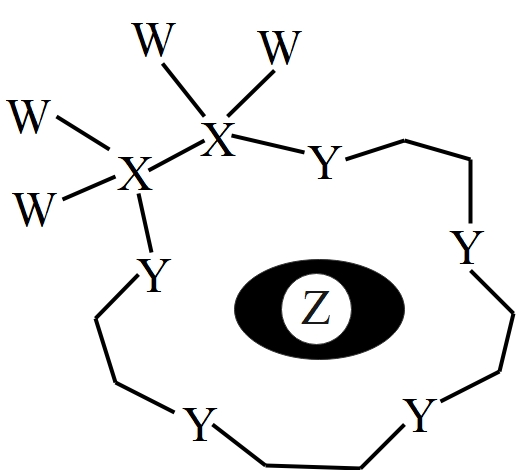
该超分子的形成体现了超分子的自组装特征
","$\\text{X}{{\\text{W}}_{4}}$形成的晶体堆积属于分子非密堆积,${{\\text{W}}_{2}}\\text{Y}$形成的晶体堆积属于分子密堆积
","$\\rm W$、$\\rm X$、$\\rm Y$、$\\rm Z$四种元素中组成的二元化合物中只有两种离子化合物
","$\\text{W}$分别与$\\rm X$、$\\rm Y$形成的化合物的沸点,前者可能大于后者
"]四种原子序数依次递增的短周期元素$\rm W$、$\rm X$、$\rm Y$、$\rm Z$,$\rm W$、$\rm X$、$\rm Z$分别位于不同周期,则分别位于第一、第二、第三周期,则$\text{W}$为$\mathrm{H}$元素;$\text{X}$形
成$\rm 4$个共价键,则$\rm \text{X}$为$\rm \text{C}$元素;$\rm Z$是同周期中金属性最强的元素,则$\rm \text{Z}$为$\rm \text{Na}$元素;$\rm \text{Y}$形成$\rm 2$个共价键,原子序数比$\rm \text{C}$大,比$\rm \text{Na}$小,说明$\rm \text{Y}$原子核外有$\rm 2$个电子层,最外层有$\rm 6$个电子,则$\rm \text{Y}$是$\rm \mathrm{O}$元素,据此解答。
$\rm A$.“组合”成该超分子过程,能识别碱金属离子,体现了超分子的分子识别特征,$\rm A$错误;
$\rm B$.$\rm \text{C}{{\text{H}}_{4}}$与$\rm {{\text{H}}_{2}}\text{O}$均为分子晶体,$\rm {{\text{H}}_{2}}\text{O}$形成的晶体中$\rm {{\text{H}}_{2}}\text{O}$分子之间的主要作用力是氢键$\rm ($当然也存在范德华力$\rm )$,每个水分子周围只有$\rm 4$个紧邻的水分子,属于分子非密堆积;甲烷是非极性分子,分子间作用力主要是范德华力,则$\rm \text{C}{{\text{H}}_{4}}$形成的晶体堆积属于分子密堆积,$\rm B$错误;
$\rm C$.$\rm \mathrm{H}$、$\rm \text{C}$、$\rm \mathrm{O}$、$\rm \text{Na}$四种元素中组成的二元化合物中属于离子化合物的有$\rm \text{N}{{\text{a}}_{2}}\text{O}$、$\rm \text{N}{{\text{a}}_{2}}{{\text{O}}_{2}}$、$\rm \text{NaH}$等,即至少有三种离子化合物,$\rm C$错误;
$\rm D$.因水分子间存在氢键,$\rm \text{X}$与$\rm \text{W}$组成的简单化合物的沸点一定比$\rm \text{Y}$与$\rm \text{W}$组成的简单化合物的沸点低,即沸点:$\rm \text{C}{{\text{H}}_{4}}\lt {{\text{H}}_{2}}\text{O}$,但碳、氢元素可组成一大类化合物$\rm ——$烃,烃的沸点可能大于水、过氧化氢的沸点,所以$\rm \text{W}$分别与$\rm X$、$\rm Y$形成的化合物的沸点,前者可能大于后者,$\rm D$正确;
故选:$\rm D$
高中 | 离子化合物题目答案及解析(完整版)
