高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
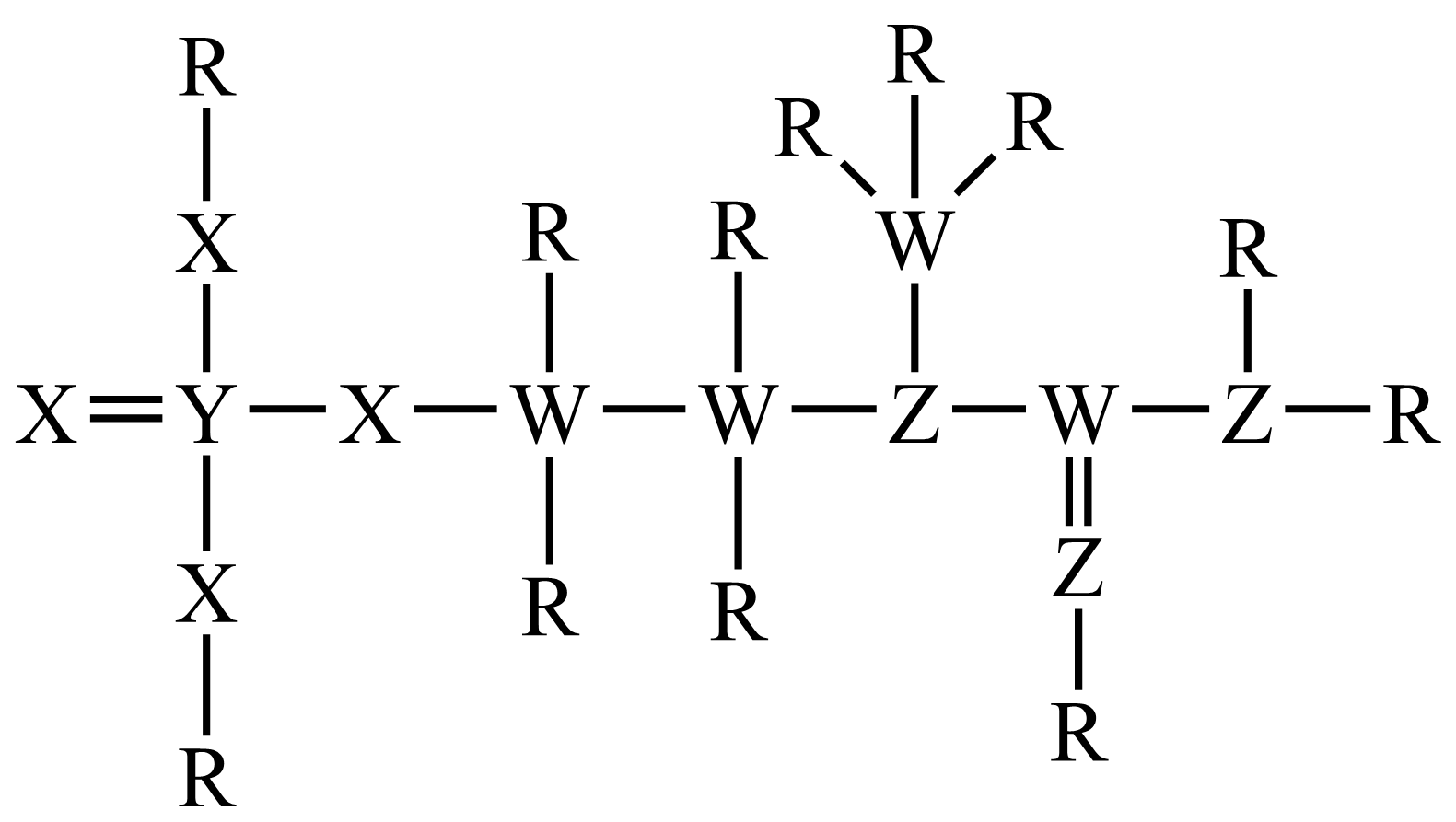
一种可为运动员补充能量的物质,其分子结构式如图。已知$\rm R$、$\rm W$、$\rm Z$、$\rm X$、$\rm Y$为原子序数依次增大的短周期主族元素,$\rm Z$和$\rm Y$同族,则$(\quad\ \ \ \ )$
沸点:$\\text{Z}{{\\text{R}}_{\\text{3}}}\\lt \\text{Y}{{\\text{R}}_{\\text{3}}}$
","最高价氧化物的水化物的酸性:$\\text{Z}\\lt \\text{W}$
","第一电离能:$\\text{Z}\\lt \\text{X}\\lt \\text{W}$
","$\\text{ZX}_{\\text{3}}^{-}$和$\\text{WX}_{\\text{3}}^{\\text{2-}}$空间结构均为平面三角形
"]$\rm Y$可形成$\rm 5$个共价键,$\rm Z$可形成$\rm 3$个共价键,$\rm Z$和$\rm Y$同族,$\rm Y$原子序数比$\rm Z$大,即$\rm Z$为$\rm N$元素,$\rm Y$为$\rm P$元素,$\rm W$可形成$\rm 4$个共价键,原子序数比$\rm N$小,即$\rm W$为$\rm C$元素,$\rm R$可形成$\rm 1$个共价键,原子序数比$\rm C$小,即$\rm R$为$\rm H$元素,$\rm X$可形成$\rm 2$个共价键,原子序数在$\rm N$和$\rm P$之间,即$\rm X$为$\rm O$元素,综上:$\rm R$为$\rm H$元素、$\rm W$为$\rm C$元素、$\rm Z$为$\rm N$元素、$\rm X$为$\rm O$元素、$\rm Y$为$\rm P$元素。
$\rm A$.由于$\rm NH_{3}$可形成分子间氢键,而$\rm PH_{3}$不能,因此沸点:$\rm NH_{3}\gt YH_{3}$,故$\rm A$错误;
$\rm B$.$\rm W$为$\rm C$元素、$\rm Z$为$\rm N$元素,由于非金属性:$\rm C\lt N$,因此最高价氧化物的水化物的酸性:$\rm H_{2}CO_{3}\lt HNO_{3}$,故$\rm B$错误;
$\rm C$.同周期元素从左到右第一电离能有增大趋势,Ⅱ$\rm A$族、Ⅴ$\rm A$族原子第一电离能大于同周期相邻元素,即第一电离能:$\text{C}\lt \text{O}\lt \text{N}$,故$\rm C$错误;
$\rm D$.$\text{NO}_{3}^{-}$的中心原子价层电子对数为$3+\dfrac{5+1-2\times 3}{2}=3$,属于$\rm sp^{2}$杂化,为平面三角形, $\text{CO}_{\text{3}}^{\text{2}-}$的中心原子价层电子对数为$3+\dfrac{4+2-2\times 3}{2}=3$,属于$\rm sp^{2}$杂化,为平面三角形,故$\rm D$正确;
故选:$\rm D$
高中 | 杂化轨道理论题目答案及解析(完整版)
