高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
一种从电子工业废渣(主要成分为金、银、钯,含有机物及其他金属杂质)提取贵金属的工艺流程如下。
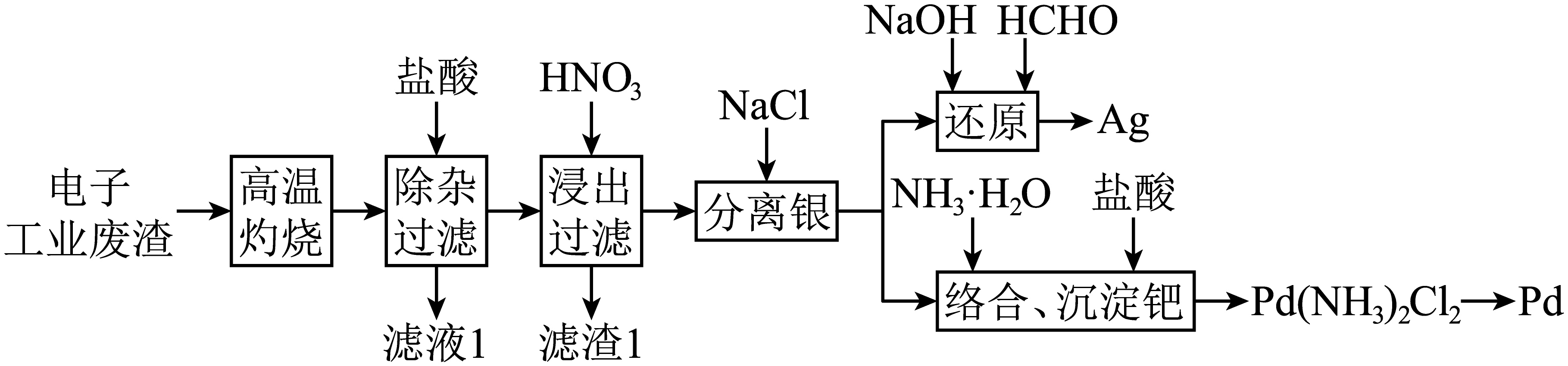
已知:室温下,${{ {K}}_{\text{sp}}}\left( \text{AgCl} \right)$为$1.8\times {{10}^{-10}}$,当溶液中离子浓度小于${{10}^{-5}}\;\rm \text{mol}/\text{L}$时,可认为离子沉淀完全。
回答下列问题:
“高温灼烧”时温度控制在$400\sim 500\;^\circ \rm C $的原因是 。
温度低于$\\rm 400\\;\\rm ^\\circ\\rm C$,有机物燃烧不充分;温度高于$\\rm 500\\;\\rm ^\\circ\\rm C$,会使$\\rm Pd$转化为$\\rm PdO$,不利于盐酸除杂
"]]温度低于$\rm 400\;\rm ^\circ\rm C$,有机物燃烧不充分;温度高于$\rm 500\;\rm ^\circ\rm C$,会使$\rm Pd$转化为$\rm PdO$,不利于盐酸除杂,故“高温灼烧”时温度控制在$400\sim 500\;^\circ \rm C $;
“分离银”加入$\rm NaCl$反应生成 沉淀(填化学式),在$1{{\text{ m}}^{3}}$含$0.01\text{ mol/L A}{{\text{g}}^{+}}$的浸出液中至少加入 $\text{kg NaCl}$才能使$\text{A}{{\text{g}}^{+}}$沉淀完全(保留小数点后两位数字)。
$\\rm AgCl$;$\\rm 0.59$
"]]氯离子和银离子生成氯化银沉淀,“分离银”加入$\rm NaCl$反应生成$\rm AgCl$沉淀;在$1{{\text{ m}}^{3}}$含$0.01\text{ mol/L A}{{\text{g}}^{+}}$的浸出液中$\text{A}{{\text{g}}^{+}}$沉淀完全,需要反应后$ {c}\left( \text{C}{{\text{l}}^{-}} \right)=\dfrac{{{ {K}}_{\text{sp}}}\left( \text{AgCl} \right)}{ {c}\left( \text{A}{{\text{g}}^{+}} \right)}=\dfrac{1.8\times {{10}^{-10}}}{{{10}^{-5}}}\text{ mol/L=1}\text{.8}\times \text{1}{{\text{0}}^{-5}}\text{ mol/L}$,至少加入$\text{1}\text{.8}\times \text{1}{{\text{0}}^{-5}}\text{ mol/L}\times {{10}^{\text{3}}}\text{ L}\times 5\text{8}\text{.5 g/mol+}0.01\text{ mol/L}\times {{10}^{\text{3}}}\text{ L}\times 5\text{8}\text{.5 g/mol}\rm =586\;\rm g=0.59\;\rm kg\;\rm NaCl$才能使$\text{A}{{\text{g}}^{+}}$沉淀完全;
“还原”步骤的化学方程式为 。
$4\\text{AgCl}+\\text{HCHO}+6\\text{NaOH}=4\\text{Ag}+\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}+4\\text{NaCl}+4{{\\text{H}}_{2}}\\text{O}$
"]]“还原”步骤的反应为碱性条件下,氯化银和甲醛发生氧化还原反应生成银单质、碳酸钠,结合质量守恒还生成氯化钠、水,反应中银化合价由$\rm +1$变$\rm 0$、碳化合价由$\rm 0$变为$\rm +4$,结合电子守恒,化学方程式为$4\text{AgCl}+\text{HCHO}+6\text{NaOH}=4\text{Ag}+\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}+4\text{NaCl}+4{{\text{H}}_{2}}\text{O}$;
用水合肼$\left( {{\text{N}}_{2}}{{\text{H}}_{4}}\cdot {{\text{H}}_{2}}\text{O} \right)$还原$\text{Pd}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{2}}\text{C}{{\text{l}}_{2}}$得到金属$\rm Pd$,其化学方程式为 。
${{\\text{N}}_{2}}{{\\text{H}}_{4}}\\cdot {{\\text{H}}_{2}}\\text{O}+2\\text{Pd}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{2}}\\text{C}{{\\text{l}}_{2}}=2\\text{Pd}\\downarrow +{{\\text{N}}_{2}}\\uparrow +4\\text{N}{{\\text{H}}_{4}}\\text{Cl}+{{\\text{H}}_{2}}\\text{O}$
"]]用水合肼$\left( {{\text{N}}_{2}}{{\text{H}}_{4}}\cdot {{\text{H}}_{2}}\text{O} \right)$还原$\text{Pd}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{2}}\text{C}{{\text{l}}_{2}}$得到金属$\rm Pd$,水合肼中氮化合价由$\rm -2$变为$\rm 0$、$\rm Pd$化合价由$\rm +2$变为$\rm 0$,结合电子守恒,其化学方程式为${{\text{N}}_{2}}{{\text{H}}_{4}}\cdot {{\text{H}}_{2}}\text{O}+2\text{Pd}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{2}}\text{C}{{\text{l}}_{2}}=2\text{Pd}\downarrow +{{\text{N}}_{2}}\uparrow +4\text{N}{{\text{H}}_{4}}\text{Cl}+{{\text{H}}_{2}}\text{O}$;
从滤渣$\rm 1$中可回收金,其回收流程如下:
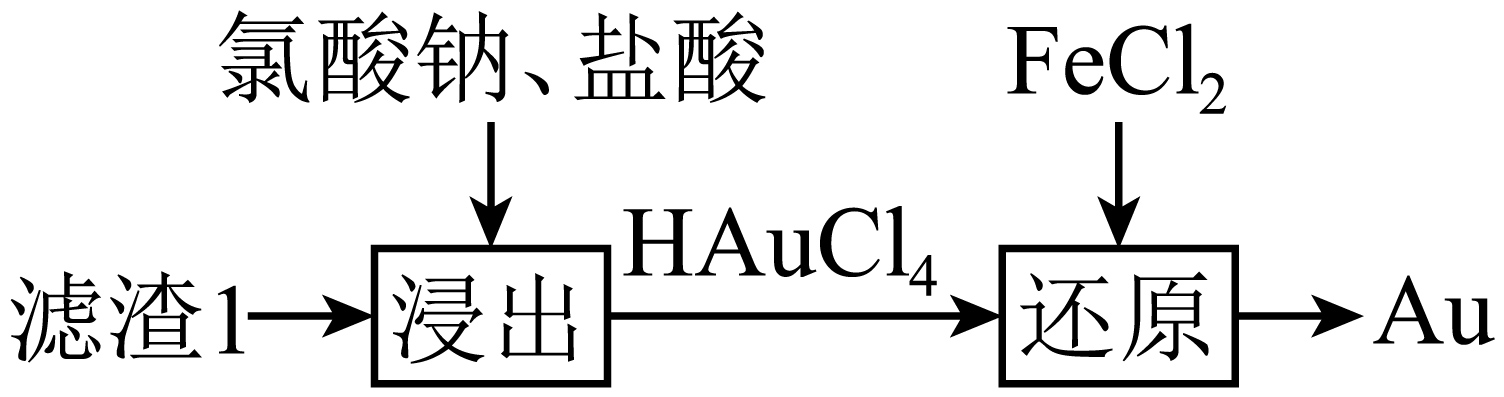
①“还原”步骤中,氧化剂与还原剂的物质的量之比为 。
②黄金按质量分数分级(如$\rm 12K$、$\rm 18K$、$\rm 22K$、$\rm 24K$),纯金为$\rm 24K$,一种$\text{Au}-\text{Cu}$合金的晶胞结构如图所示。
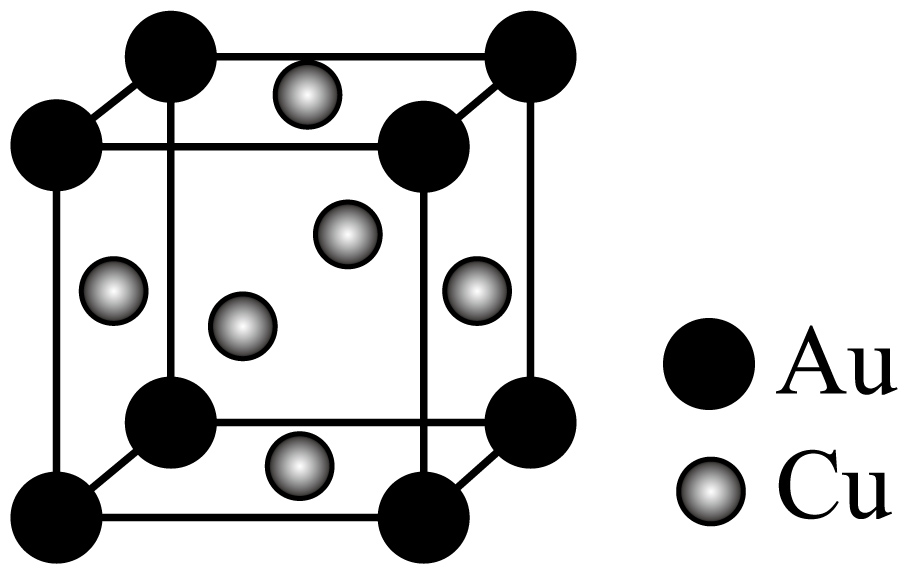
该合金中$\rm Au$的配位数为 ,为 $\rm K$金。
$\\rm 1:3$;$\\rm 12$;$\\rm 12$
"]]①$\rm \text{HAuC}{{\text{l}}_{4}}$为氧化剂,还原为$\rm Au$,$\rm \text{FeC}{{\text{l}}_{2}}$为还原剂,氧化为$\rm \text{F}{{\text{e}}^{3+}}$,结合电子守恒,存在$\rm \text{HAuC}{{\text{l}}_{4}}\sim 3{{e}^{-}}\sim 3\text{FeC}{{\text{l}}_{2}}$,氧化剂与还原剂的物质的量之比为$\rm 1:3$;
②由图,该合金中离$\rm Au$最近且相邻的铜原子数为$\rm 3\times \dfrac{1}{2}\times 8=12$,配位数为$\rm 12$;据“均摊法”,晶胞中含$\rm 8\times \dfrac{1}{8}=1$个$\rm Au$、$\rm 6\times \dfrac{1}{2}=3$个$\rm Cu$,该金合金的化学式为$\rm \text{AuC}{{\text{u}}_3}$,$\rm Au$的质量分数为$\rm \dfrac{197}{197+64\times 3}=50.6\%$,为$\rm 12K$金。
高中 | 配合物理论题目答案及解析(完整版)
