高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
锌在电池制造、合金生产等领域有着广泛的用途。现代冶炼锌主要采取湿法工艺。
工业浸锌:向闪锌矿$\rm ($主要成分为难溶性$\rm ZnS)$中加入稀硫酸与软锰矿$\rm ($主要成分为$\text{Mn}{{\text{O}}_{2}}\rm )$可得到$\text{ZnS}{{\text{O}}_{4}}$与$\text{MnS}{{\text{O}}_{4}}$混合溶液和单质$\rm S$。
已知:$\textit{K}_{\text{a}1}(\text{H}_{2}\text{S})=1.07\times10^{-7}$,$\textit{K}_{\text{a}2}(\text{H}_{2}\text{S})=1.26\times10^{-13}$,$\textit{K}_{\text{sp}}(\text{ZnS})=2.5\times10^{-22}$
工业浸锌时加入$\text{FeS}{{\text{O}}_{4}}$能“催化”$\rm ZnS$的浸出,其过程可表示为:
ⅰ:$\text{Mn}{{\text{O}}_{2}}+2\text{F}{{\text{e}}^{2+}}+4{{\text{H}}^{+}}=\text{M}{{\text{n}}^{2+}}+2\text{F}{{\text{e}}^{3+}}+2{{\text{H}}_{2}}\text{O}$
ⅱ: ;
①过程ⅱ的离子方程式为 ;
②为验证上述“催化”过程。补充完整实验方案:取酸化的$\text{FeS}{{\text{O}}_{4}}$溶液, ;
$\\text{ZnS}+2\\text{F}{{\\text{e}}^{3+}}=\\text{Z}{{\\text{n}}^{2+}}+2\\text{F}{{\\text{e}}^{2+}}+\\text{S}$ ; 加入$\\rm KSCN$溶液,溶液无色,加入适量$\\text{Mn}{{\\text{O}}_{2}}$,溶液变红,取上层红色溶液,向其中加入$\\rm ZnS$,振荡,红色褪去
"]]①工业浸锌时加入$\text{FeS}{{\text{O}}_{4}}$能“催化”$\rm ZnS$的浸出,先发生反应:$\text{Mn}{{\text{O}}_{2}}+2\text{F}{{\text{e}}^{2+}}+4{{\text{H}}^{+}}=\text{M}{{\text{n}}^{2+}}+2\text{F}{{\text{e}}^{3+}}+2{{\text{H}}_{2}}\text{O}$,$\rm Fe^{3+}$再氧化$\rm ZnS$,离子方程式为:$\text{ZnS}+2\text{F}{{\text{e}}^{3+}}=\text{Z}{{\text{n}}^{2+}}+2\text{F}{{\text{e}}^{2+}}+\text{S}$;
②为验证上述“催化”过程。补充完整实验方案:取酸化的$\text{FeS}{{\text{O}}_{4}}$溶液,先加$\rm KSCN$溶液,无现象,没有$\rm Fe^{3+}$,再加入$\rm MnO_{2}$,$\rm MnO_{2}$氧化$\rm Fe^{2+}$得到$\rm Fe^{3+}$,溶液变红色,再取上层清液,加入$\rm ZnS$,振荡,红色褪去,说明$\rm Fe^{3+}$把$\rm ZnS$氧化,自身转化为$\rm Fe^{2+}$
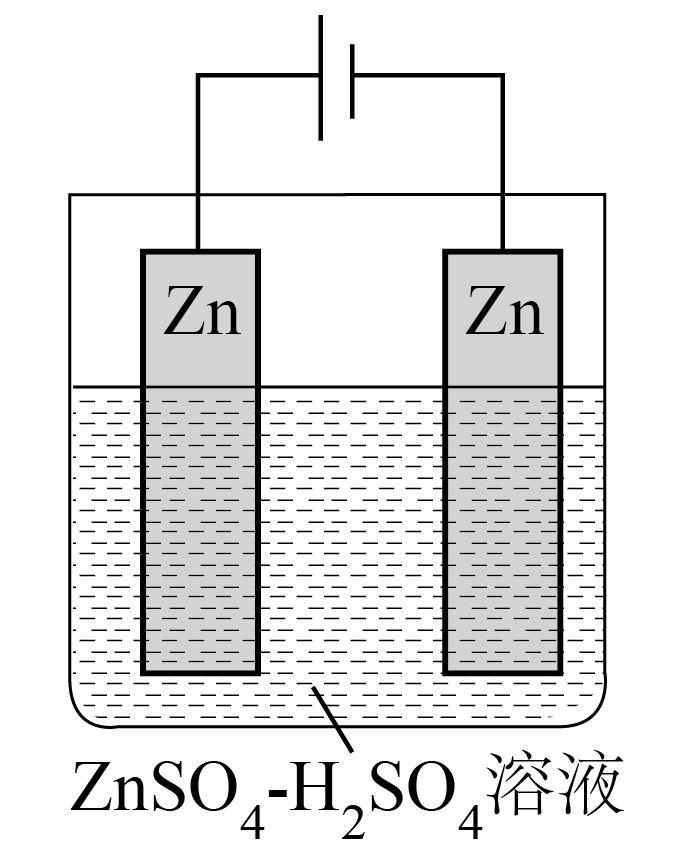
工业电解制锌粉:以$\text{ZnS}{{\text{O}}_{4}}$和${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$混合液$\rm (pH$为$\rm 4$~$\rm 6)$为电解质溶液,用上图装置制取锌粉。一定条件下,测得电流效率为$\rm 80\%$。$\rm ($已知:电流效率$=\dfrac{实际析出金属的量}{理论析出金属的量}\times 100\%\rm )$,制得$\rm 65\;\rm g$锌粉时,电解质溶液中$\text{Z}{{\text{n}}^{2+}}$的质量增加 $\rm \;\rm g$。
$\\rm 16.25$
"]]一定条件下,测得电流效率为$\rm 80\%$,制得$\rm 65\;\rm g$锌粉时,电解质溶液中$\text{Z}{{\text{n}}^{2+}}$的质量增加为$\dfrac{65\ \text{g}}{80\text{ }\!\!\%}\rm -65\;\rm g=16.25\;\rm g$;
实验室氯氨法炼锌:一定条件下,向闪锌矿中加入$\text{N}{{\text{H}}_{4}}\text{Cl}$与$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$混合溶液并通入${{\text{O}}_{2}}$,可将$\rm ZnS$转化为${{[\text{Zn}{{(\text{N}{{\text{H}}_{3}})}_{4}}]}^{2+}}$。结合平衡移动原理解释${{\text{O}}_{2}}$对浸锌的作用是: ;
$\\rm ZnS$在溶液中存在平衡:$\\text{ZnS}(\\text{s})\\rightleftharpoons \\text{Z}{{\\text{n}}^{2+}}(\\text{aq})+{{\\text{S}}^{2-}}(\\text{aq})$,${{\\text{O}}_{2}}$与${{\\text{S}}^{2-}}$反应生成$\\rm S$,${{\\text{S}}^{2-}}$浓度减小,促进$\\rm ZnS$溶解平衡右移
"]]$\rm ZnS$在溶液中存在平衡:$\text{ZnS}(\text{s})\rightleftharpoons \text{Z}{{\text{n}}^{2+}}(\text{aq})+{{\text{S}}^{2-}}(\text{aq})$,${{\text{O}}_{2}}$与${{\text{S}}^{2-}}$反应生成$\rm S$,${{\text{S}}^{2-}}$浓度减小,促进$\rm ZnS$溶解平衡右移,$\rm Zn^{2+}$最终结合$\rm NH_{3}$分子,转化为${{[\text{Zn}{{(\text{N}{{\text{H}}_{3}})}_{4}}]}^{2+}}$;
硫化锌可作为锂离子电池的负极材料。在充电过程中,$\rm ZnS$晶胞的组成变化如图所示。
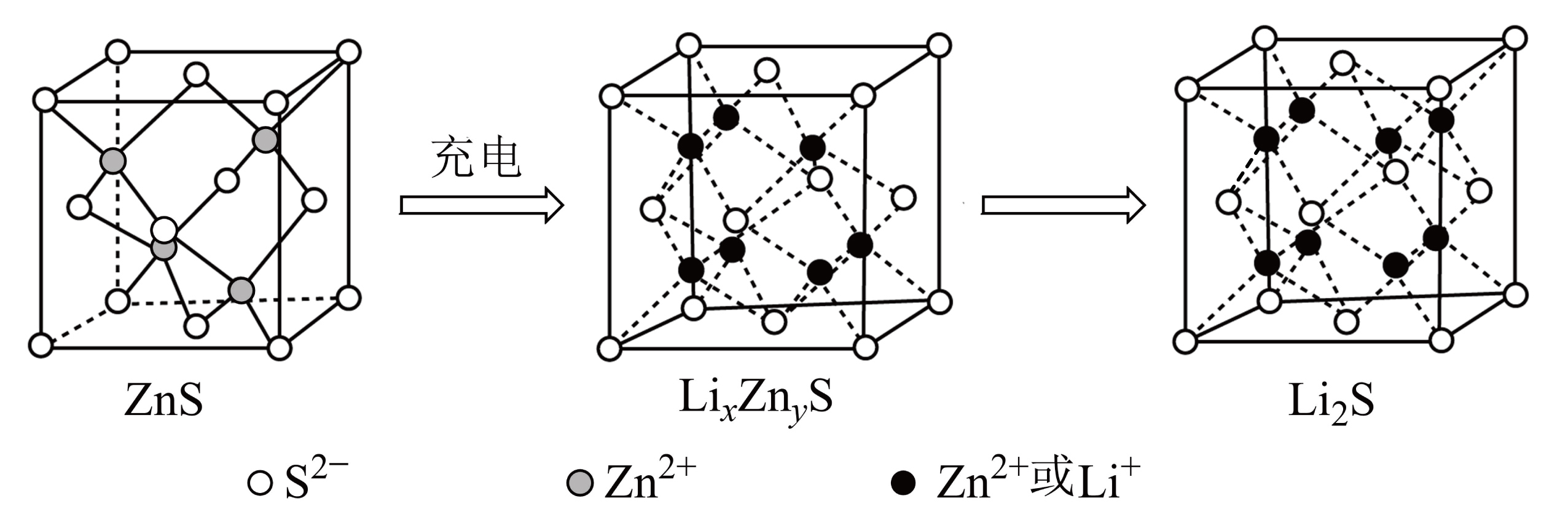
充电过程中$\rm ZnS$到$\text{L}\text{i}_{\textit{x}}\text{Z}\text{n}_{\textit{y}}\text{S}$的电极方程式为 $\rm (\textit{x}$和$y$用具体数字表示$\rm )$。
$4\\text{ZnS}+6\\text{L}{{\\text{i}}^{+}}+6{{\\text{e}}^{-}}=3\\text{Zn}+4\\text{L}{{\\text{i}}_{1.5}}\\text{Z}{{\\text{n}}_{0.25}}\\text{S}$
"]]根据晶胞图可知,在$\text{L}\text{i}_{\textit{x}}\text{Z}\text{n}_{\textit{y}}\text{S}$晶胞中,$\rm S^{2-}$个数为$\rm 8\times \dfrac{1}{8}\rm +6\times \dfrac{1}{2}\rm =4$,$\rm Li^{+}$或$\rm Zn^{2+}$的个数共$\rm 7$个,由化合价代数和为$\rm 0$的原则,化学式为$\rm Li_{6}ZnS_{4}$,或者$\rm Li_{1.5}Zn_{0.5}S$,充电过程中$\rm ZnS$得电子与$\rm Li^{+}$结合生成$\rm Li_{1.5}Zn_{0.5}S$和$\rm Zn$单质,电极方程式为:$4\text{ZnS}+6\text{L}{{\text{i}}^{+}}+6{{\text{e}}^{-}}=3\text{Zn}+4\text{L}{{\text{i}}_{1.5}}\text{Z}{{\text{n}}_{0.25}}\text{S}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
