高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲烷重整过程会产生积碳使催化剂失活,通过加入$\text{C}{{\text{O}}_{2}}$、${{\text{H}}_{2}}\text{O}$或${{\text{O}}_{2}}$可以在一定条件下减少或消除积碳。反应分别为:
反应$\rm 1$:$\text{C}{{\text{H}}_{4}}(\text{g})\rightleftharpoons \text{C}(\text{s})+2{{\text{H}}_{2}}(\text{g})\qquad\Delta {{H}_{1}}=+74.9\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm 2$:$\text{C}{{\text{H}}_{4}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\qquad\Delta {{H}_{2}}=+247.3\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm 3$:$\mathrm{CH}_{4}(\mathrm{g})+\mathrm{H}_{2} \mathrm{O}(\mathrm{g}) \rightleftharpoons \mathrm{CO}(\mathrm{g})+3 \mathrm{H}_{2}(\mathrm{g})\qquad\Delta {{H}_{3}}=+205.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm 4$:$\text{C}{{\text{H}}_{4}}(\text{g})+\dfrac{1}{2}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\qquad\Delta {{H}_{4}}=-35.6\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$\text{C}(\text{s})$摩尔燃烧焓$\Delta {{H}_{5}}=$ $\rm ($用含$\Delta\!\!\text{ }{{\textit{H}}_{\text{1}}}$、$\Delta\!\!\text{ }{{\textit{H}}_{\text{2}}}$、$\Delta\!\!\text{ }{{\textit{H}}_{\text{4}}}$的代数式表示$\rm )$。根据以上数据,摩尔燃烧焓:$\text{CO}(\text{g})$ $\mathrm{H}_{2}(\mathrm{g})\rm ($㙋“$\rm \gt $”,“$\rm =$”,“$\rm \lt $”或“无法判断”$\rm )$。
$\\text{2 }\\!\\!\\Delta\\!\\!\\text{ }{{\\textit{H}}_{\\text{4}}}-\\!\\!\\Delta\\!\\!\\text{ }{{\\textit{H}}_{\\text{1}}}-\\!\\!\\Delta\\!\\!\\text{ }{{\\textit{H}}_{\\text{2}}}$ ; 无法判断
"]]碳的摩尔燃烧焓是指$\rm 100\ Kpa$时,$\rm 1$ $\rm mol$碳完全燃烧生成$\rm CO_{2}(g)$时的焓变,即:目标化学方程式为$\text{C}\left( \text{s} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$,利用盖斯定律,目标热化学方程式为$\text{C}\left( \text{s} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$,可由$\rm 2\times $反应$\rm 4-$反应$\rm 1-$反应$\rm 2$得到,即$\Delta {{\textit{H}}_{5}}=\text{2 }\!\!\Delta\!\!\text{ }{{\textit{H}}_{\text{4}}}-\!\!\Delta\!\!\text{ }{{\textit{H}}_{\text{1}}}-\!\!\Delta\!\!\text{ }{{\textit{H}}_{\text{2}}}$;
$\rm CO(g)$的摩尔燃烧焓,反应$\rm 6$:$\text{CO}\left( \text{g}\right)+\dfrac{\text{1}}{\text{2}}\text{O}_{\text{2}}\left( \text{g}\right)\text{=C}\text{O}_{\text{2}}\left( \text{g}\right)\qquad\Delta\textit{H}_{6}$,$\rm H_{2}(g)$的摩尔燃烧焓,反应$\rm 7$:${{\text{H}}_{\text{2}}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)$$\qquad\Delta H_{7}<0$,反应$\rm 6-$反应$\rm 7$得:$\rm CO\left( \text{g}\right)+\text{H}_{2}\text{O}\left( \text{l}\right)\rightleftharpoons CO_{2}\left( \text{g}\right)+\text{H}_{2}\left( \text{g}\right)\qquad\Delta \textit{H}$,要比较$\rm CO(g)$的摩尔燃烧焓与$\rm H_{2}(g)$的摩尔燃烧焓的相对大小,即要求$\rm CO\left( \text{g}\right)+\text{H}_{2}\text{O}\left( \text{l}\right)\rightleftharpoons CO_{2}\left( \text{g}\right)+\text{H}_{2}\left( \text{g}\right)\qquad\Delta \textit{H}$与$\rm 0$的大小关系;反应$\rm 3-$反应$\rm 2$得反应$\rm 8$:$\rm CO\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons C{{O}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta {\textit{H}_{8}}=2.5.2-247.3=-42.1\;\rm kJ/mlol$,而过程$\rm 9$:$\rm H_{2}O(l)=$ $\rm H_{2}O(g)\qquad\Delta \textit{H}_{9}>0$,反应$\rm 8+$过程$\rm 9$得:$\rm CO\left( \text{g}\right)+\text{H}_{2}\text{O}\left( \text{l}\right)\rightleftharpoons CO_{2}\left( \text{g}\right)+\text{H}_{2}\left( \text{g}\right)\qquad\Delta \textit{H}=\Delta \textit{H}_{8}+\Delta \textit{H}_{9}$,无法判断$\Delta {{H}_{8}}+\Delta {{H}_{9}}$大于$\rm 0$还是小于$\rm 0$ ,即无法判断$\rm CO(g)$的摩尔燃烧焓与$\rm H_{2}(g)$的摩尔燃烧焓的相对大小;
将$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( \text{C}{{\text{O}}_{2}} \right)=1:1$的混合气体置于恒温恒压的密闭容器中,忽略反应$\rm 3$与反应$\rm 4$。测得充分反应后积碳产生量$\rm [C(s)$占体系中碳总量的摩尔分数$\rm ]$与温度、压强之间的关系如图。
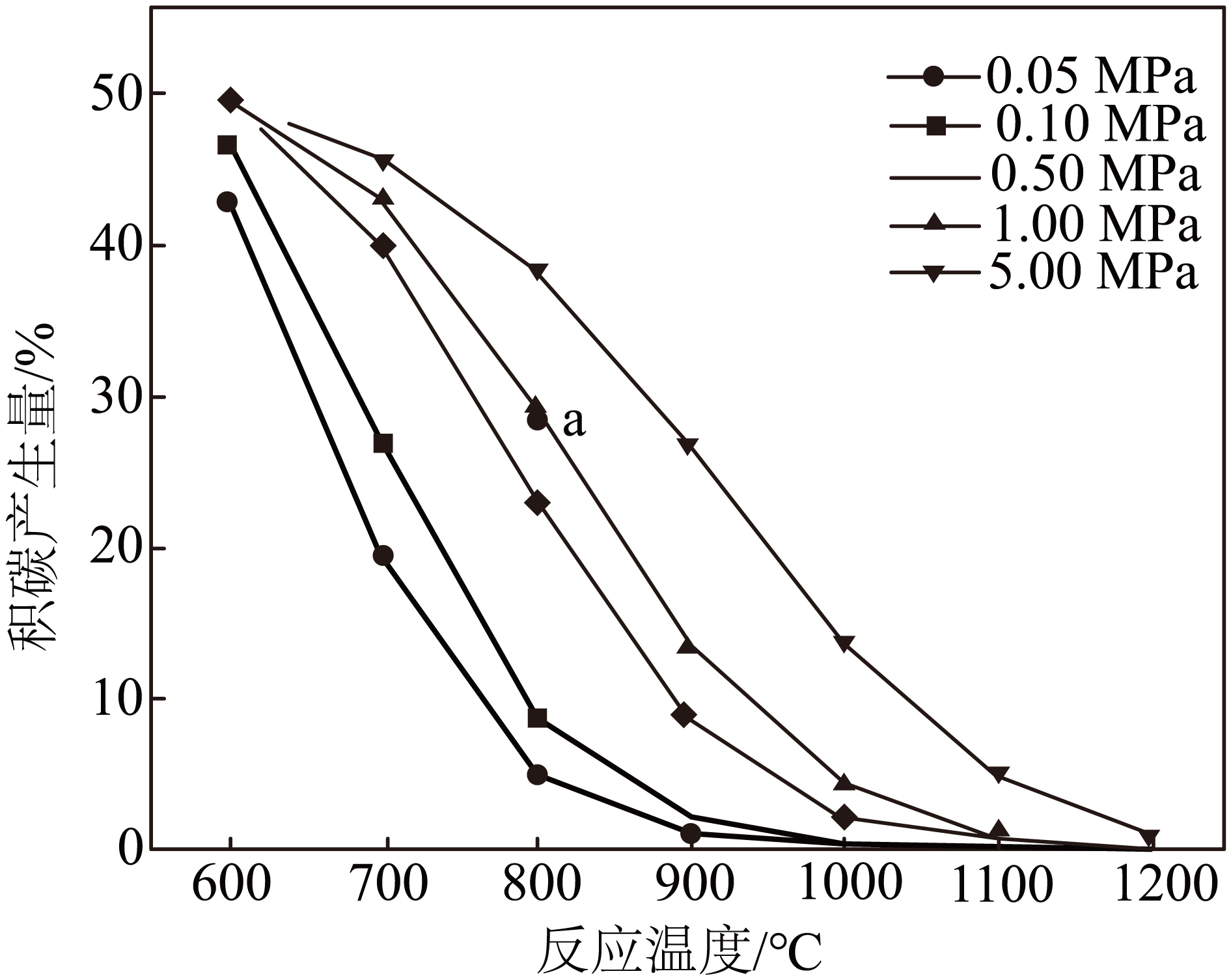
①温度升高会导致积碳减少或完全消失,原因为 。在$\rm a$点向容器中通入一定量${{\text{N}}_{2}}$,则积碳产生量会 $\rm ($填“增大”、“减少”或“不变”$\rm )$。
②在$T\ ^\circ\rm C$、$p\rm\ kPa$条件下,充分反应后,容器体积增加了$\rm 25\%$,反应$\rm 1$的压强平衡常数为$\dfrac{2p}{25}\ \text{kPa}$,则此时$\text{CO}$的分压为 $\rm \;\rm kPa$,反应$\rm 2$的压强平衡常数为${{K}_{\text{p}}}=$ $\rm kPa^{2}$。此时,下列能够促使反应$\rm 2$正向移动的有 $\rm ($填标号$\rm )$。
$\rm A$.加入少量$\text{C}\left( \text{s} \right)$ $\rm B$.升高温度 $\rm C$.加入合适催化剂 $\rm D$.以上均不可
随着温度升高,反应$\\rm 2$正向进行的程度更大 ; 减少 ;$0.2p$ ; $\\dfrac{4}{225}\\textit{p}^{\\text{2}}$; $\\rm AB$
"]]①反应$\rm 1$和反应$\rm 2$均为吸热反应,升温,反应正方向进行程度增大,由于反应$\rm 2$正向进行的程度更大,甲烷减少,导致反应$\rm 1$逆移,故温度升高会导致积碳减少或完全消失;在$\rm a$点向容器中通入一定量$\rm N_{2}$,由于容器为恒温恒压容器,通入$\rm N_{2}$但总压不变,各组分分压减小,即等效减压,由图示可知,相同条件下,压强越小积碳产生量越少,所以在$\rm a$点向容器中通入一定量${{\text{N}}_{2}}$,积碳产生量减少;
②在$T\ ^\circ\rm C$、$p$ $\rm kPa$条件下,充分反应后,容器体积增加了$\rm 25\%$,反应$\rm 1$的压强平衡常数为$\dfrac{2p}{25}\ \text{kPa}$。设初始时 $n\rm(CH_{4})=\textit{n}(CO_{2})=1$ $\rm mol$,反应后气体总物质的量为 $\rm 2$ $\rm mol\times 125\%=2.5$ $\rm mol$。
假设反应$\rm 1$生成 $x$ $\rm mol$ $\rm C(s)$和 $2x$ $\rm mol$ $\rm H_{2}(g)$,反应$\rm 2$生成$2y$ $\rm mol$ $\rm CO(g)$和$2y\rm\ mol\ H_{2}(g)$ ,则平衡时$\rm CH_{4}$的物质的量为$1-x-y\rm\ mol$:
反应$\rm 1\begin{align} & \begin{matrix} {} & {} \\ \end{matrix}\begin{matrix} \begin{matrix} \begin{matrix} {} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix}\text{C}{{\text{H}}_{4}}(\text{g})\rightleftharpoons \text{C}(\text{s})+2{{\text{H}}_{2}}(\text{g}) \\ &起始量 \text{mol}\begin{matrix} \begin{matrix} {} & {} & {} \\ \end{matrix} & {} & \begin{matrix} 0 & {} & 0 \\ \end{matrix} \\ \end{matrix} \\ & 变化量\text{mol}\begin{matrix} &\textit{x} & {} & \begin{matrix} {} & \textit{x} & \begin{matrix} {} & 2\textit{x} & {} \\ \end{matrix} \\ \end{matrix} \\ \end{matrix} \\ &平衡量 \text{mol}\begin{matrix} {} & \begin{matrix} {} & {} \\ \end{matrix} & {} & \begin{matrix} \begin{matrix} \textit{x} & {} & 2\textit{x} \\ \end{matrix} & {} & {} \\ \end{matrix} \\ \end{matrix} \\ \end{align}$; 反应$\rm 2\begin{align} & \begin{matrix} {} & {} \\ \end{matrix}\begin{matrix} \begin{matrix} \begin{matrix} {} & {} \\ \end{matrix} & {} \\ \end{matrix} & {} \\ \end{matrix}\text{C}{{\text{H}}_{\text{4}}}\text{(g)+C}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2CO(g)+2}{{\text{H}}_{\text{2}}}\text{(g)} \\ & 起始量\text{mol}\begin{matrix} {} & {} & {} & {} \\ \end{matrix}\begin{matrix} 1 & {} & {} & {} \\ \end{matrix}\begin{matrix} 0 & {} & {} & 0 \\ \end{matrix} \\ & 变化量\text{mol}\begin{matrix} {} & \textit{y} & {} & {} \\ \end{matrix}\begin{matrix} \textit{y} & {} & {} & 2\textit{y} \\ \end{matrix}\begin{matrix} {} & {} & 2\textit{y} & {} \\ \end{matrix} \\ & 平衡量\text{mol}\begin{matrix} {} & \begin{matrix} {} & {} \\ \end{matrix} & 1-\textit{y} & {} \\ \end{matrix}\begin{matrix} {} & 2\textit{y} & {} & {} \\ \end{matrix}\begin{matrix} 2\textit{y} & {} & {} & {} \\ \end{matrix} \\ \end{align}$,平衡时气体的总物质的量为①$1-x-y+1-y+2x+2y+2y=2.5\;\rm mol$:反应$\rm 1$的$\textit{K}_{\text{p}}=\dfrac{\textit{p}^{\text{2}}\left( \text{H}_{\text{2}}\right)}{\textit{p}\left( \text{C}\text{H}_{\text{4}}\right)}=\dfrac{\left( \dfrac{2\textit{x}+2\textit{y}}{2.5}\textit{p}\right)^{2}}{\dfrac{1-\textit{x}-\textit{y}}{2.5}\textit{p}}=\dfrac{2\textit{p}}{\text{25}}\ \text{kPa}$,假设总压为 $p$ $\rm kPa$ ,则:$\textit{p}\left( \text{C}{{\text{H}}_{\text{4}}} \right)=\dfrac{\textit{n}\left( \text{C}{{\text{H}}_{\text{4}}} \right)}{{\textit{n}_{总}}}\textit{p}=\dfrac{1-x-y}{2.5}\textit{p}$,$\textit{p}\left( {{\text{H}}_{\text{2}}} \right)=\dfrac{\textit{n}\left( {{\text{H}}_{2}} \right)}{{\textit{n}_{总}}}\textit{p}=\dfrac{2x+2y}{2.5}\textit{p}$, 代入平衡常数表达式:②$\dfrac{\left( \dfrac{2x+2y}{2.5}\textit{p}\right)^{2}}{\dfrac{1-x-y}{2.5}\textit{p}}=\dfrac{2\textit{p}}{\text{25}}\ \text{kPa}$,联立①②解得:$x=-0.1$,$y=0.3$,起始并没有加碳,$x$不可能小于$\rm 0$,因此该条件下,反应$\rm 1$未进行,反应后气体物质的量增加$\rm 0.5\;\rm mol$,则有$2y=0.5$,$\textit{p}\left( \text{CO} \right)=\dfrac{n\left( \text{CO} \right)}{{{n}_{总}}}\textit{p}=\dfrac{2y}{2.5}\textit{p}=\dfrac{0.5}{2.5}\textit{p}=0.2\textit{p}\rm\ kPa$,所以反应$\rm 2$的压强平衡常数为:$\textit{K}_{\text{p}}=\dfrac{\textit{p}^{\text{2}}\left( \text{CO}\right)\textit{p}^{\text{2}}\left( \text{H}_{\text{2}}\right)}{\textit{p}\left( \text{C}\text{H}_{\text{4}}\right)\textit{p}\left( \text{C}\text{O}_{\text{2}}\right)}=\dfrac{\left( 0.2\textit{p}\right)^{2}\times\left( 0.2\textit{p}\right)^{2}}{\left( \dfrac{1-0.25}{2.5}\textit{p}\right)\times\left( \dfrac{1-0.25}{2.5}\textit{p}\right)}=\dfrac{4\textit{p}^{2}}{225}\ \text{kPa}$;
$\rm A$.最初没有加碳,此时加碳,对反应$\rm 1$,$\textit{Q}=\dfrac{\textit{p}^{2}\left( \text{H}_{2}\right)}{\textit{p}\left(\rm CH_{4}\right)}=\sqrt{\textit{K}_{\text{p}2}}=\sqrt{\dfrac{4\textit{p}^{2}}{225}}\rm kPa=\dfrac{2\textit{p}}{15}kPa\gt\dfrac{2\textit{p}}{25}kPa=\textit{K}_{\text{p}1}$,反应$\rm 1$逆向进行,甲烷物质的量增多,反应$\rm 2$正向移动,$\rm A$正确;
$\rm B$.因为反应$\rm 2$为吸热反应,升高温度有利于正向移动,$\rm B$正确;
$\rm C$.催化剂可以加快反应速率,但不改变平衡,$\rm C$错误;
$\rm D$.由以上分析可知,$\rm A$、$\rm B$正确,$\rm D$错误;
故选:$\rm AB$
高中 | 化学平衡常数题目答案及解析(完整版)
